모든 생물의 설계 정보는 '게놈(Genome)'에 적혀 있다. 게놈을 해독하면, 그 생물 전체를 이해할 수 있다. 지금까지 사람을 비롯해 여러 가지 생물의 게놈이 해독되었다. 그리고 게놈을 읽는 장치인 '시퀸서(Sequencer)'도 눈부시게 진보하고 있다. 한 번에 대량의 게놈을 해독할 수 있도록 개량되었고, 의료 현장에서 사용되는 시퀸서도 등장했으며, 해독된 '문자의 배열'의 의미를 찾기 위해 사용되는 시퀸서도 있다.
0. 목차
- 인간 게놈 프로젝트
- 시퀀서는 여러 가지 방향으로 진화했다.
- 염기 배열의 의미는 무엇인가?
- 세포나 조직에 존재하는 mRNA의 수
- DNA의 작용 방식을 조절하는 네트워크
- 차세대 시퀀서의 활약

1. 인간 게놈 프로젝트
1991년에 엄청난 국제적 프로젝트 '인간 게놈 프로젝트'가 시작되었다. '인간 게놈 프로젝트(Human Genome Project)'는 인간이 가지고 있는 게놈의 모든 염기 서열을 해석하기 위한 프로젝트이다. '인간 게놈 프로젝트'는 12년이라는 오랜 세월이 걸렸으며, 3000억~4000억 달러에 이르는 많은 비용이 들어갔다. 그리고 2003년에는 사람의 전체 게놈 해독이 종료되었다는 선언이 나왔다.
DNA는 당과 인산으로 이루어진 기둥을 따라 4종의 염기가 늘어선 분자이다. '게놈을 해독한다'는 것은 염기의 배열 순서를 읽는다는 뜻이다. 염기의 배열 순서를 읽는 장치를 '시퀀서(Sequencer)'라고 한다. 인간 게놈 프로젝트'에서는 '생어 염기서열 분석법(Sanger Sequencing Method, 생어법)'이라는 방법에 의해 염기를 읽었다.
염기를 읽을 때는 '아데닌(A)'과 '티민(T)' 그리고 '구아닌(G)'과 '사이토신(C)'이 각각 짝을 짓는 성질을 이용한다. 우선 해독하려는 DNA를 조각으로 만들어 대량으로 늘린다. 이 조각을 '새로운 염기'나 '효소'와 함께 두면 조각과 짝을 이루듯 염기가 늘어서 DNA 사슬이 합성되어 간다. 새로운 염기 중에는 '표지(Marker)'를 붙인 염기도 섞여 있다. 이 표지는 염기 종류마다 서로 다르므로, DNA 사슬이 합성된 뒤 표지를 보면, 염기가 어떤 순서로 늘어서 있는지를 알 수 있다.
1-2. 생어 염기서열 분석법(생어법)
DNA 분자는 너무 작아 염기 배열을 직접 볼 수는 없다. 그러나 DNA 분자의 양을 인공적으로 늘리고, 'A와 T', 'G와 C'가 짝이 되어 달라붙는 성질을 이용하면, 원래 염기 배열을 해독할 수 있다. 아래에 그 방법을 설명하였다.
- 먼저 해독 대상인 DNA를 1000배 이상 늘려둔다. 늘린 2가닥 사슬의 DNA 각각은 1가닥 상태로 분해된다. 그림에서는 5염기쌍의 배열을 그렸지만, 실제로는 해독 대상 DNA를 50~400염기마다 인공적으로 크고 두껍게 자른다.
- DNA의 한쪽 사슬과 많은 염기를 반응시키면, 'A와 T', 'G와 C'가 각각 자연히 쌍을 이루어 달라붙는 성질에 의해 염기가 자동적으로 이어져 나간다. 하지만 2003년 당시에 '염기'를 직접 검출하는 방법은 실용화되지 않았으므로, '염기'뿐만 아니라 '인공적인 염기'도 반응시킨다. '인공적인 염기'에는 4종의 염기마다 색깔이 다른 형광 분자를 붙여 두고, 나중의 과정에서 검출할 수 있게 해 둔다. 또 더 이상 사슬이 앞으로 이어지지 못하도록 장치를 해 둔다.
- 염기가 자동적으로 이어져 나갈 때 '염기'가 어디서 사용될지는 무작위로 정해지므로, 한쪽 사슬의 길이가 1염기, 2염기, 3염기, 4염기, 5염기로 서로 다른 DNA가 만들어진다. (이 단계에서는 어느 염기가 사용되었는지 알 수 없다.) 각 DNA의 끝에는 형광 분자가 붙는다.
- 한쪽 사슬의 길이가 서로 다른 DNA 분자를 젤 같은 '장애물'이 가득 찬 관으로 일제히 지나게 한다. DNA 분자 한쪽 사슬의 길이가 짧을수록 빨리 통과한다. 통과한 차례대로 형광의 색깔을 검출하면, 염기의 차례와 종류를 알 수 있다. (단, 이것은 해독 대상의 염기 배열 그 자체는 아니다)
- 검출한 염기의 순번과 종류를 바탕으로 컴퓨터에서 'A↔C', 'C↔G'의 변환이 이루어지며, 드디어 해독 대상 그 자체의 배열을 알 수 있다. 이렇게 해서 읽은 많은 조각의 배열을 서로 이으면 게놈 전체의 배열이 된다. (단, 길이가 서로 다른 DNA 분자를 준비해야 하므로 효율이 나쁘다.)

2. 시퀀서는 여러 가지 방향으로 진화했다.
인간 게놈 해독의 종료 선언이 나온 뒤에도 도전은 끝나지 않았다. 이 프로젝트의 책임자였던 미국의 '프랜시스 콜린스(Francis Collins, 1950~)'가 다음 목표로 '단 1000달러로 사람 전체 게놈을 해독할 수 있는 기술을 완성시키겠다고 선언한 것이다. 그 후 생어법과는 다른 여러 가지 방법에 근거한 시퀀서가 개발되었다. 이들 시퀸서를 통틀어 '차세대 시퀀서'라고 한다.
그러면 어떻게 해야 적은 비용으로 빨리 게놈을 읽을 수 있을까? 이것은 '차세대 시퀀서'가 당초에 노린 목표였다. 하지만 게놈을 읽기 위한 여러 가지 방법이 개발되자 목표도 늘어났다. 예컨대 '긴 조각 상태에서 단숨에 읽을 수 있는 방법'이 나왔다. 또 DNA 및 DNA가 감긴 단백질 '히스톤'에 달라붙어 있는 화학 물질의 수식을 읽는 방법 등도 나왔다. 참고로 히스톤이 '아세틸화(Acetylation)', '인산화(Phosphorylation)', '메틸화(Methylation)' 등 어떤 종류의 화학적 변화를 받는 것을 '히스톤 수식(Histone Modification)'이라고 한다.
이들 가운데 개량 경쟁이 가장 치열한 방향은 당초 목표였던 '낮은 비용의 빠른 해독'으로, '한 번에 얼마나 대량의 DNA를 읽을 수 있는가?'라는 것이었다. 그러면 어떻게 이것을 실현할 수 있을까? 가장 큰 개량점은 장치의 기반 위에 DNA 조각이 모인 집단을 많이 만드는 것이다. 하나하나의 반응 접시 안에서 DNA 조각을 늘리고, 조각과 짝이 되는 DNA 사슬을 합성한다. 다수의 반응 접시로 이 반응을 동시에 진행하고 또 자동으로 진행되도록 했기 때문에 대량의 DNA 조각을 해독할 수 있었다.
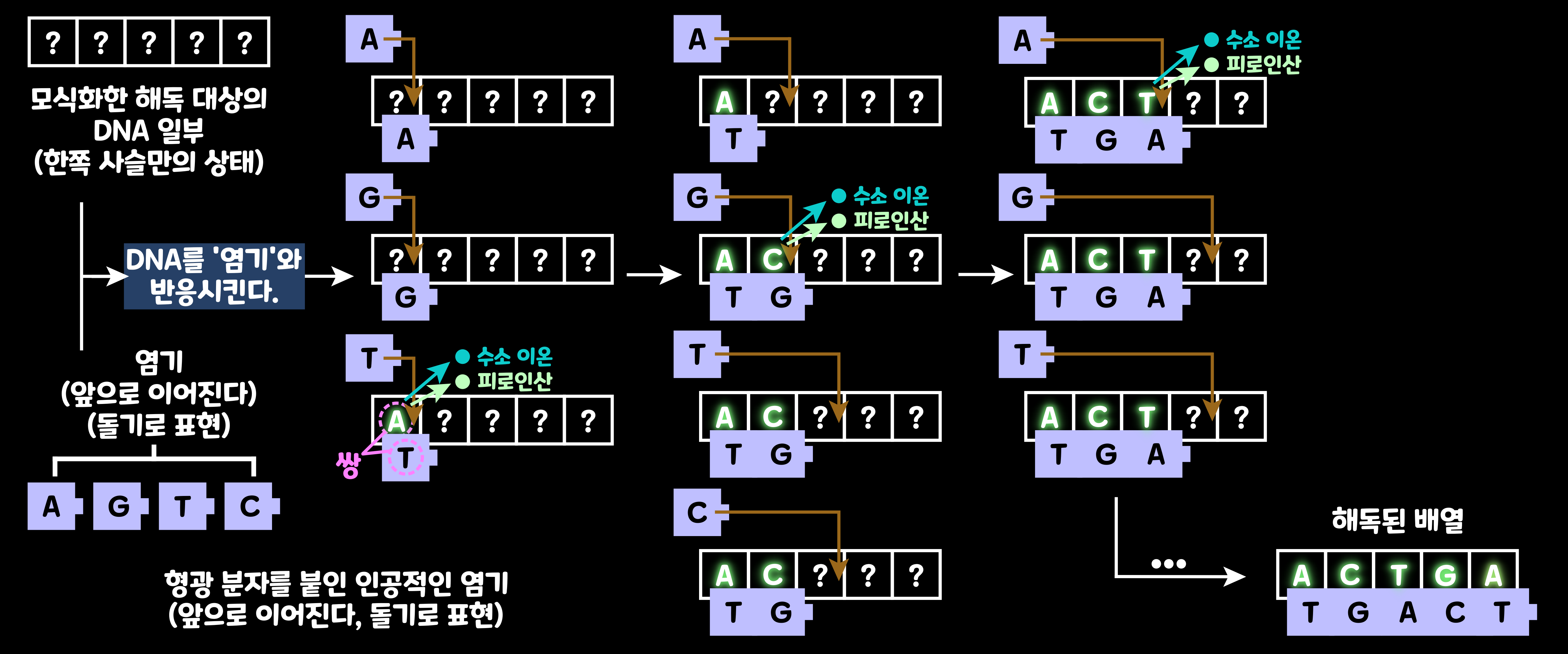
2-1. 프로톤 측정법
나아가 염기 배열이 이루어지는 차례를 검출하는 방법에도 많은 연구가 이루어졌다. 그중에서 '프로톤 측정법'을 살펴보자. 이 방법에서는 염기에 검출용 표지는 붙일 수 없다. 염기가 DNA 사슬에 들어갈 때, '수소 이온(H+)'이나 '피로인산(Pyrophosphate)'이 방출되는데, 이때 반응 접시 안 용액의 pH가 산성으로 바뀌므로 그 변화를 검출하려는 것이다. 염기를 1종씩 넣어 관찰하면 pH 변화가 일어났을 때 넣은 염기가 DNA 사슬에 들어간 염기라고 곧 알 수 있다. 짝인 DNA 사슬을 합성하면서 동시에 그 염기의 검출을 할 수 있으므로 효율이 좋다.
- 해독 대상인 DNA를 늘려, 각각을 1가닥 사슬의 상태로 분해해 둔다. 이 준비 과정은 기본적으로 종래의 방법과 같다.
- 차세대 시퀸서의 해독 방법에서는 앞으로 이어져 갈 염기를 1종씩 DNA와 반응시켜 나간다. 염기가 이어질 때 방출되는 것을 알 수 있는 '피로인산'이나 '수소 이온'을 검출한다.
- 쌍이 되는 염기 조각을 반응시켰을 때만 달라붙고, 한쪽 사슬이 길어진다. 아래 그림의 예에서는 A와 반응시켜도 아무것도 검출되지 않았지만, 계속해서 G를 반응시켰더니 수소 이온 등이 검출되었다. 즉 염기가 DNA 사슬에 달라붙었다. 이로써 두 번째 염기의 종류는 G와 쌍을 이루는 C라고 알 수 있다. 그다음 T와 반응시켜도 아무것도 검출되지 않았으므로, 세 번째의 ?는 A가 아니다. 그다음 C와 반응시켜도 아무것도 검출되지 않았으므로 세 번째의 ?는 G도 아니다.
- 4종의 염기를 차례로 반응시키는 과정을 반복함으로써, 염기의 순서를 알 수 있다. 같은 종류의 염기가 2개, 3개 연속되는 부분이 있을 경우에는 방출되는 분자의 2배, 3배로 늘어나므로 1개의 경우와 구별할 수 있다. 이렇게 읽은 다수의 배열을 서로 이으면 게놈 전체를 재현할 수 있다. (종래의 방법과는 달리 조립하면서 염기 배열을 알 수 있으므로 효율이 좋다.)
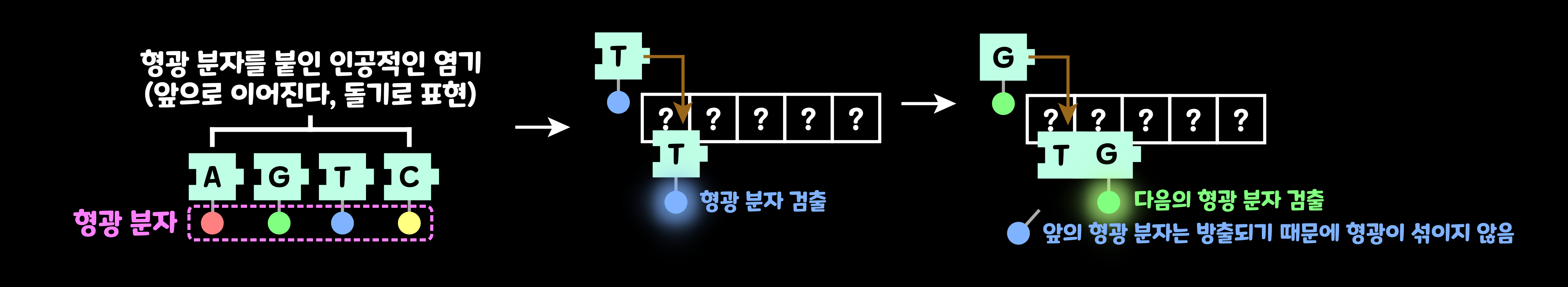
2-2. Sequncing by Synthesis법
그리고 대량 처리를 가장 많이 할 수 있고, 가장 흔히 사용되는 방법 중에는 'Sequncing by Synthesis법'이 있다. 이 방법에서는 기반 '플로셀(Flow Cell)'에 DNA 조각을 늘리고, 같은 조각이 모인 집단, 즉 '클러스터(Cluster)'를 많이 만든다. DNA 사슬의 합성은 클러스터마다 이루어지므로 '플로셀'에서는 동시에 많은 반응을 진행시킬 수 있다.
'Sequncing by Synthesis법'에서는 '인공적인 염기'에 '형광 표지(Fluorescent Label)'가 붙어져 있다. '인공적인 염기'에 붙은 형광 분자로부터 나오는 빛을 검출한다. 이 인공적인 염기는 '생어법'에서 사용되는 것과는 '장치'가 다르다. 이 '인공적인 염기'의 형광 분자는 다음 염기가 DNA 사슬에 더해지면 떨어지기 때문에, 이웃끼리 염기의 형광이 섞이지 않고 연속해 재빨리 검출이 이루어진다.
3. 염기 배열의 의미는 무엇인가?
3-1. 복사를 실마리로 배열의 내용을 조사한다.
지금까지 살펴본 것처럼, 게놈을 해독한다는 것은 DNA의 염기 배열을 밝히는 것이다. 하지만 A, T, G, C 염기의 배열 순서를 쳐다보기만 해서는 아무것도 알 수 없다. '인간 게놈 프로젝트'가 꾸준히 진행되는 동시에, 염기 배열의 의미를 알아야 한다는 움직임이 일본의 이화학연구소에서 시작되었다. 그리고 2000년에 이화학연구소가 주도하는 국제 컨소시엄 '팬텀(FANTOM)'이 결성되었다.
FANTOM이 주목한 것은 RNA이다. DNA 염기 배열을 바탕으로 단백질이 만들어질 때는 우선 복사가 이루어지는데, 이 복사에 DNA와 아주 비슷한 화학 물질인 mRNA가 사용된다. DNA의 염기 배열 모두가 단백질의 설계 정보는 아니다. 그러면 DNA의 어느 부분이 단백질의 설계 정보를 담당하는 것일까? 그리고 그것은 어떤 단백질일까? 이러한 내용을 알기 위해 mRNA가 사용된다. mRNA는 원래의 DNA 사슬과 짝인 염기 배열을 갖도록 만들어진다. 즉, 역으로 mRNA의 짝이 되는 염기 배열의 DNA를 합성하면, 원래의 DNA 사슬 가운데 단백질의 설계 정보를 가진 부분만 빼낼 수 있다는 것이다. mRNA 주형으로부터 '역전사 효소'의 작용으로 생성되는 한 가닥 DNA를 '상보적 DNA(cDNA)'라고 한다.
FANTOM은 mRNA 특유의 배열을 표지로 세포나 조직으로부터 mRNA를 골라냈다. 그리고 그 배열을 바탕으로 생쥐의 완전한 cDNA를 합성해 시퀀서로 그 염기 배열을 읽었다. 그리고 그 cDNA가 어떤 단백질의 설계 정보를 담당하는지를 밝혀 데이터 베이스와 cDNA의 견본을 만들었다. 2002년까지 60770개나 되는 완전한 cDNA의 견본과 분석 데이터가 갖추어졌다.
3-2. DNA의 약 80%가 의미 있는 내용이다.
그러면 cDNA는 애초에 모든 DNA 중 어디에 있으며, 어떻게 복사가 이루어진 것일까? FANTOM은 연구에 더욱 박차를 가했다. 실은 하나의 영역에서 1종의 mRNA만 만들어지는 것은 아니다. 같은 영역 안에서도 어디서부터 복사하기 시작하는지에 따라 서로 다른 mRNA와 단백질이 생긴다. 게다가 더욱 복잡한 점은, 같은 복사 시작점에서 오른쪽 방향으로 복사하는 경우가 있는가 하면, 왼쪽 방향으로 복사하는 경우도 있다는 사실이다. 복사 방향이 달라지면 당연히 서로 다른 mRNA와 단백질이 생긴다.
FANTOM은 DNA에 복사의 시작점과 진행 방향을 모두 대응시키는 작업을 시도했다. 그리고 그 목적을 달성하기 위해 'CAGE법'이라는 방법을 개발했다. 이것은 복사 시작점에 있는 RNA의 독특한 구조를 포착하는 방법이다. 복사가 시작된 곳인 '복사된 RNA의 맨 앞'에는 '캡(cap)'이라는 구조가 만들어진다. CAGE법에서는 세포나 조직에서 캡 구조를 가진 RNA를 포착한다. 그 RNA로부터 cDNA를 작성하고 복사가 시작된 맨 앞부분의 염기 부분을 읽는 것이다. 이리하여 복사 시작점과 진행 방향을 DNA에 대응시킬 수 있었다. 그 결과, 놀라운 사실이 밝혀졌다. 그때까지는 모든 DNA 속의 불과 2% 정도가 단백질의 설계 정보를 담당하는 mRNA로서 복사되리라고 생각되었다. 하지만 이 대응 작업에서 복사된 RNA를 모두 살펴보았더니, 무려 70% 이상이 RNA로 복사된다는 사실이 알려졌다. 이 발견을 'RNA 대륙의 발견'이라고 부른다.
3-3. ENCODE 프로젝트
'인간 게놈 프로젝트(Human Genome Project)'에 이어서 2003년에는 'ENCODE 프로젝트(ENCODE Project)'가 시작되었다. ENCODE란 The Encyclopedia of DNA Elements Project'의 약어로, '인간 DNA의 백과사전 작성 계획'이다. 즉 'ENCODE 프로젝트'는 해독된 인간 게놈의 염기 배열의 의미를 전부 조사해, 인간 게놈에 들어 있는 모든 정보의 일람표를 만들자는 계획이었다.
FANTOM도 이 계획에 참가했다. CAGE법을 사용해 인간 게놈의 시작점을 분석한 것이다. 'ENCODE 프로젝트(ENCODE Project)'에서는 복사 시작점 이외에, 복사를 촉진하거나, 방해하는 단백질 '전사 효소'가 달라붙는 것이나, 히스톤의 수식 상황 등의 정보를 모았다.
그리고 2012년 9월, 인간 게놈에서는 약 2%의 단백질 설계 정보 이외에 약 80%나 되는 영역이 RNA로 복사되며, 그들 RNA는 DNA로부터 단백질이 만들어질 때 '조절 역할'을 한다는 사실이 밝혀졌다. 조절 역할을 하는 RNA의 길이는 다양하며, 작용하는 방식도 다종다양하다. 예컨대 가장 흔히 연구되는 조절 역할 RNA의 하나인 'HOTAIR(핫에어)'에 의해, 특정 유전자를 복사하는 스위치가 켜지거나 꺼진다. 이 메커니즘이 정상적으로 작동하지 않으면, 유방암이나 대장암으로 이어질 수도 있다. 사람의 경우 '조절 역할'을 하는 RNA가 최대 10만 종일 수도 있고, 대부분의 역할 규명은 앞으로 이루어져야 한다. 게다가 조절 역할 RNA에는 생물 종마다 고유한 것이 많다고 생각된다. 사람의 개성을 살펴보는 데, 이런 RNA 정보가 표시된 게놈 영역의 연구는 반드시 필요하다.
4. 세포나 조직에 존재하는 mRNA의 수
지금까지 살펴본 것처럼 '차세대 시퀀서'는 여러 가지 방향으로 진화해 왔다. 그 가운데 단 1개 분자의 DNA를 사용해 염기 배열을 읽을 수 있는 '차세대 시퀀서'가 있다. 1개 분자만의 DNA로 염기 배열을 해독할 수 있으므로, DNA를 늘릴 필요가 없다. DNA 사슬 안에는 인공적으로 늘리기 쉬운 곳과 어려운 곳이 있다. 이 때문에 세포나 조직으로부터 꺼낸 RNA를 cDNA로 변환해, 다른 차세대 시퀀서처럼 인공적으로 늘리면, 그 세포나 조직에 있던 RNA의 정확한 양을 알 수는 없다.
하지만 'CAGE법'을 이용해 세포나 조직으로부터 골라낸 mRNA가 cDNA로 변환되고, 복사 시작점을 '1개 분자로부터 해독할 수 있는 차세대 시퀀서'로 해독했을 경우, 같은 배열을 가졌다고 판단된 mRNA의 수는 그대로 그 세포나 조직에 존재하는 mRNA의 수가 된다. 그러면 세포나 조직에 존재하는 mRNA의 수로 어떤 정보들을 얻어낼 수 있을까?
- mRNA가 많을수록, 그것에 대응하는 단백질이 많이 만들어지는 셈이다. 따라서 CAGE법을 통해 '언제 어느 세포와 조직에서 어느 단백질이 어느 정도 많이 만들어졌는가?'라는 정보도 알 수 있다.
- mRNA가 복사된 수를 아는 것은 질병의 진단에도 도움이 된다. 어떤 유전자로부터 mRNA로 복사되는 것을 조절하는 전사 인자의 양과 작용하는 방식은 질병의 진행과 바뀌는 경우가 있다.
- 또 유전자의 염기 배열 자체에 이상이 없어도 유전자나 히스톤의 수식 이상으로 일어나는 병도 있다. 이 경우, 유전자의 변이가 아니라, mRNA가 복사된 수를 확인해 두지 않으면 질병을 예측할 수는 없다.
- 실제로 '전이되기 쉬운 암세포'와 '그렇지 않은 암세포' 사이에는 복사 상태에 차이가 있다. 이 때문에 최초에 암이 발생한 부위에서 암조직을 떼내서 세포 속의 mRNA를 조사하면, 그 암이 앞으로 전이를 일으킬 가능성이 높은지 아닌지를 더욱 정확하게 예측할 수 있으며, 최적의 치료 방법을 찾을 수 있다.
5. DNA의 작용 방식을 조절하는 네트워크
FANTOM은 'CAGE법'과 '1개 분자로부터 해독할 수 있는 차세대 시퀀서'를 사용해, '조절 역할 RNA'와 '전사 인자'가 DNA의 어디에 작용하는지, 그리고 세포 안에 어느 정도 있는지를 조사했다.
그리고 'Basin Netwrok(베이슨 네트워크)'라는 설을 제창했다. 이 설에 의하면, 세포 안에서는 본래 '조절 역할 RNA'와 '전사 인자'는 서로 복사되는 것을 억제하거나 촉진해서 세포 안에서의 농도를 유지한다. 이들의 농도가 일정하다는 것은 만들어진 단백질의 양이 일정하다는 뜻이다. 단백질은 세포의 모양·구조·기능을 담당한다. 따라서 단백질의 종류와 양이 일정하다는 것은, 그 세포의 겉모양과 기능도 일정한 상태에 있다는 의미이다.
그러나 어떤 원인으로 '조절 역할 RNA'와 '전사 인자'의 농도 균형이 무너지면, 세포는 다른 세포로 분화되거나, 암세포나 된다. 즉 '조절 역할 RNA'와 '전사 인자'의 네트워크는 그대로 그 세포의 개성이 된다. 심장 근육 세포에는 심장 근육 세포 특유의 네트워크가, 신경 세포에는 신경 세포 특유의 네트워크가 있는 것이다. 즉, 어느 세포를 다른 세포로 바꾸어 주려면, 그 세포의 전사 인자'를 주면 된다. 'iPS 세포(유도만능 줄기세포)'는 이 원리로 만들어졌다.
6. 차세대 시퀀서의 활약
'차세대 시퀀서'를 이용해 조사되는 정보는 'DNA의 염기 배열', 'mRNA와 조절 역할 RNA의 복사 시작점과 방향', '복사 수', 'DNA와 히스톤의 수식 상황', '전사 인자가 결합하는 곳', '크로마틴의 3차원 구조' 등 아주 다양하다. 인간 게놈 프로젝트가 종료된 당초에는 게놈을 한 번에 대량으로 해독할 수 있는 '차세대 시퀀서'가 요구되었고, 이제 '차세대 시퀀서'는 한 번에 대량으로 게놈을 해독할 수 있게 되었다. 게다가 그 외에도 많은 종류의 분석을 할 수 있게 되었다. 게놈에 무엇이 적혀 있으며, 그 정보가 언제 어느 때 사용되는지, 또 그 정보가 사용되는 타이밍은 어떤 메커니즘으로 조절되는지를 알기 위해 시퀀서가 필요한 시대가 된 것이다. '시퀀서의 해독 기술'과 '생명 과학의 여러 분야에서 이루어진 진보'에 의해 시퀀서가 활약하는 분야는 크게 넓어지고 있다.
그러면 차세대 시퀀서는 어떤 현장에서 활약하고 있을까? 여기서부터는 '차세대 시퀀서가 가지고 있는 '대량 처리'라는 특징이 살아 있는 사례를 소개한다.
6-1. 의료 현장
우선은 의료 현장이다. 예컨대 암은 사람이 오래 살거나 환경의 영향으로 '유전자에 이상이 축적되는 질병'이다. 그러나 같은 장기에 암이 생기는 환자끼리도 이상이 발생하는 종류는 같지 않다. 요즘은 유전자의 이상에 맞추어 설계된 '분자 표적 치료제'가 많이 개발되고 있다. 그러나 이상의 종류가 사람에 따라 서로 다르므로, 같은 장기의 암 환자들이 같은 약을 복용해도 효험이 있는 사람이 있는가 하면 효험이 없는 사람도 있다. 또 부작용이 생기는 사람도 있다.
이런 상황에서 유전자 이상의 종류를 미리 알 수 있으며, 그 사람에게 적합한 약을 투여할 수 있다. 이처럼 환자의 몸에서 채취한 DNA를 '차세대 시퀀서'로 읽고 유전자의 이상을 조사해서, 거기에 맞는 치료 방법을 찾아나 나가는 것을 '맞춤 의료'라고 부른다.
6-2. 메타 게놈 분석
또 대량으로 처리할 수 있는 '차세대 시퀀서'의 등장함에 따라 '메타 게놈 분석'이 널리 이루어지게 되었다. '메타 게놈 분석(Metagenome Analysis)'이란 지금까지와 마찬가지로 한 종의 유전체를 넘어, 주어진 환경 내에 존재하는 여러 종의 유전체를 연구하는 학문이다. 예컨대 한 사람의 몸속이나 하나의 특정한 장소와 같이, 어떤 환경 속에 있는 모든 생물의 DNA를 함께 조각으로 만들고 통틀어 배열을 읽는 것이다. 이러한 '메타 게놈 분석'을 함으로써, 배양할 수 없는 생물을 검출하거나, 그 환경 속의 생물종의 구성을 조사할 수 있다.
나아가 이 방법으로는 생물종과 별도로, 특정 환경 속의 유전자의 종류만 볼 수 있으므로, 그 환경 속에 있는 생물의 집단이 거기서 어떤 작용을 하는지 알 수 있다. 또 사람이 산업적으로 이용할 수 있는 유용한 유전자를 새로 발견할 수도 있다.
- 상재균의 분석: 메타 게놈 분석을 사용해 가장 활발하게 진행되는 사례는 '상재균의 분석'이다. '상재균'이란 생물의 몸에 항상 존재하며, 기본적으로 해를 끼치지 않는 세균을 말한다. 상재균은 배양하기 어려운 것이 많아서, 우리 몸에 어떤 세포가 있는지를 특정하기가 어려웠다. 그러나 메타 게놈 분석을 이용해 사람의 상재균을 조사하는 대규모 프로젝트가 세계 각지에서 진행되었다. 그 결과, 장내 세균의 구성이 체질에 관계한다는 사실이 밝혀졌다. 예컨대 비만인 사람과 비만이 아닌 사람의 장내 세균 구성에는 분명한 차이가 발견되었다. 장내 세균이 여러 가지 병에 관계되어 있다는 사실도 알려졌으며, 건강한 사람의 장내 세균 집단을 환자에게 옮기는 치료도 이루어지고 있다.
- 환경 분석: 토양, 해양, 호수 등 환경에 있는 생물의 게놈을 통째로 함께 분석할 때도 '메타 게놈 분석'이 사용된다. 예컨대 토양이나 지하수의 오염을 제거하기 위해, 오염 물질을 분해하는 미생물을 거기에 살포해 정화하는 '바이오오그멘테이션(Bioaugmentation)'이라는 방법이 있다. 미생물을 투여한 뒤 환경에 가해지는 영향을 예측하려면, 미리 그 장소의 생물 집단 구성을 알아 둘 필요가 있다. 또 오염을 분해할 수 있는 미생물을 투여한 뒤, 실제로 그곳의 생물 집단에 어떤 영향이 생기는지를 확인하는 과정도 필요하다. 이때에도 '메타 게놈 분석'이 사용된다.