0. 목차
- '바이오의약품'이란?
- '바이오의약품'과 '합성의약품' 비교
- '바이오의약품'의 진화
- '바이오의약품'의 종류
- 신약개발
- 대한민국의 신성장동력 '바이오의약품' 산업
- '바이오의약품' 관련 기업

1. '바이오의약품'이란?
'바이오의약품(Biomedicine)'이란 국가별로 그 정의가 다소 다른 측면이 있으나, 대한민국의 경우 사람이나 다른 생물체에서 유래된 것을 원료 또는 재료로 만들어진 생물의약품으로, 보건위생상 특별한 주의가 필요한 의약품으로 정의된다. '약사법'에서 정의하고 있는 의약품에 바이오의약품을 포함하여 규정하고 있으며, 하위 규정인 '생물학적 제제 등의 품목허가 심사 규정' 제2조에서 바이오의약품을 정의 하고 있다. '바이오의약품(Biomedicine)'은 생물학적 제제, 유전자재조합의약품, 세포배양 의약품, 세포치료제, 유전자치료제, 기타 식품의약품안전처장이 인정하는 제제를 포함하고 있다.
- '한국'의 바이오의약품 정의: 사람이나 다른 생물체에서 유래된 것을 원료 또는 재료로 만들어진 생물의약품으로, 보건위생산 특별한 주의가 필요한 의약품
- '미국'의 바이오의약품 정의: 인체 세포, 조직 도는 세포 유래, 조직 유래 성분으로 생산된 의약품
- '유럽'의 바이오의약품 정의: 활성 성분이 생물학적인 물질을 포함하는 의약품
1세대에 '천연물 의약품(Botanical Drug)' 중심이었고, 2세대에 '합성의약품(NME: New Chemical Drug)' 중심이었던 '제약시장'은 3세대 '바이오의약품(Biomedicine)'으로 패러다임이 전환이 이루어졌으며, 향후 블록버스터 의약품 시장을 주도할 것으로 생각된다. 3세대 '바이오의약품(Biomedicine)' 산업은 사람이나 다른 생물체에서 유래된 원료 또는 재료 기반으로 생명공학 기술을 활용하여 인류의 '건강증진', '질병예방', '치료'에 필요한 유용한 물질로 가공·생산하는 산업이다. '바이오의약품'으로는 '유전자재조합 의약품(Gene Recombination Medicine)', '세포치료제(Cell Therapy Products)', '유전자치료제(Gene Medicine)', '백신(Vaccine)' 등이 있다.
1-1. 바이오의약품 산업의 특징
'한국 바이오의약품 협회'에서 2018년에 발간한 '바이오의약품 산업 동향 보고서'에 나타난 바이오의약품 산업의 특징은 다음과 같다.
- 바이오의약품은 일반적으로 합성의약품에 비해 크기가 크고, 복잡한 고분자 구조이며, 생물체를 이용하여 복잡한 제조공정을 거쳐야 하므로 변화에 민감함.
- 대부분의 합성의약품은 경구 투여 방식이지만 바이오의약품은 단백질을 이용해 제조된 의약품으로 경구 투여 방식을 취하면 소화가 되어 약효를 발휘하기 어려워 정맥이나 근육에 주사하는 방식으로 투여됨.
- 바이오의약품은 경구투여하는 합성의약품보다 부작용이 적다는 장점을 갖고 있음.
- 임상 성공률이 높고, 희귀성 난치성 만성질환의 치료가 가능함
- 복제약의 경우 합성의약품은 화학물질의 합성 비율을 알면 쉽.게 제조가 가능한 반면, 바이오 의약품은 배양 기술과 환경, 방법에 따라 전혀 다른 물질이 나올 수 있는 가능성이 있어 복제가 쉽지 않음. 바이오의약품의 복제약인 '바이오시밀러(Biosimilar)'는 합성의약품의 복제보다 고도의 기술력이 요구되기 때문에 오리지널 의약품 대비 가격이 합성의약품의 복제약인 '제네릭(Generic)'보다 더 높은 시장 가격이 인정되고 있다.
이처럼 '바이오의약품' 산업은 초기에 막대한 자본 투자와 오랜 기간이 소요되는 반면에, 그에 따라 수반되는 '원료산업 활성화', '연구인력 확충' 등 연관 산업에 긍정적 효과를 주는 등 투자 효과가 크다. 또한 고위험·고수익 창출의 특성상 도전적인 기업가정신이 필요하며, 장기간의 투자와 함게 전략적·정책적 지원이 필요한 산업이다.
2. '바이오의약품'과 '합성의약품' 비교
최근에는 세계적으로 건강과 안전을 더욱더 추구함으로써, 기존의 합성화학물질 기반의 합성의약품은 꺼리는 추세이다. 반면에, 바이오의약품의 개발은 활발히 추진되고 있다. 한편, '바이오의약품(Biomedicine)'은 '합성의약품(NME: New Chemical Drug)'과 다른 몇 가지 특징을 지니고 있다.
'합성의약품(NME)'은 원료를 화학적 합성 방법으로 제조하는 의약품을 의미한다. '합성의약품'은 제조 방식을 표준화할 수 있어 낮은 비용으로 대량 생산이 가능하다. 하지만, 바이오의약품은 생물체에서 유래된 것을 원료로 하여 제조된 의약품으로 세포배양기 등 복잡한 생산설비가 필요하며, 동물 세포를 배양하여 생산되기 때문에, 외부환경 변화에 민감하며 품질관리가 까다로워 제조원가가 상대적으로 높다. 그뿐만 아니라 바이오의약품은 배양기술 및 제조 환경에 따라 전혀 다른 물질이 나올 수 있어 복제약 '바이오시밀러' 제조도 쉽지 않다.
'합성의약품'은 주로 알약 형태로 경구 투여 방식이 대부분이고, 일반적인 질환과 표준치료에 효과적이다. 한편, '바이오의약품'은 단백질을 이용해 제조된 의약품이므로 경구 투여 방식을 취하면 소화가 되어 약효를 발휘하기 어렵다. 그래서 주로 정맥이나 근육에 주사하는 방식으로 투여되어 경구투여하는 합성의약품보다 부작용이 적으며, 임상성공률이 높고 희귀성 난치성 만성질환의 치료 효과가 뛰어나다. 이에 바이오의약품은 기존 치료법으로 충족되지 않은 퇴행성·난치성 질환 치료제 또는 환자 맞춤형 표적치료제로 사용되고 있다. 게다가 생체유래물질을 이용하기 때문에, 독성이 낮고, 합성의약품보다 부작용이 적다는 장점을 보유하고 있다.
| - | 합성의약품 | 바이오의약품 |
| 원료 | 합성화학물질 | 생물체 유래물질(세포, 조직, 유전물질 등) |
| 사이즈 | 1000 MW 이하 | 1000 MW 이상 |
| 구조 | 물리화학적 특성이 명확한 저분자 구조 | 복잡한 고분자 당사슬구조 포함 |
| 제조 | 간단한 화합적 합성으로 대량 생산 | 복잡한 제조과정의 맞춤형 소량 생산 |
| 원료, 공정, 설비 변화가 품질에 영향이 비교적 적음 (제조 공정의 변이성이 매우 낮음) | 원료, 공정, 설비 변화가 의약품 자체를 변호 (제조 공정의 변이성이 매우 높음) | |
| 상대적으로 복제가 수비고 낮은 제조 비용 | 복제가 불가능하고 높은 제조 비용 | |
| 치료 효과 | 비교적 명확한 약리기전, 대다수 사람에게 일관적 효과 기대 | - 세포치료제: 약리기전이 불확실 - 유전자치료제: 복합적인 기전, 환자에 따른 맞춤형 치료 가능 |
| 대부분 질병의 증상 개선에 그침 | 질병의 근본적인 원인 치료 가능 | |
| 안전성 | 약물 특이적이거나 약물 대사와 관련된 이상 반응 | 생물체 유래물로 독성은 낮으나 면역 거부 반응, 종양 발생 등의 이상 반응이 있음. 특히 장기 안전성 결과는 매우 부족 |
| 비임상 시험 | 동물 시험을 통하여 약물의 독성 및 효과를 예측 가능 | 동물 시험으로 인체 결과를 예측하는 데 한계 |
| 투약 방법 | 대부분 경구·주사 등 일반적 투여 경로 | 대부분 주사, 주입, 이식 등 시술을 동반한 투여 |
| 복제약 | 제네릭 | 바이오시밀러 |
3. '바이오의약품'의 진화
'바이오의약품'은 제제별로 '백신(Vaccine)'과 '혈액 제제(Blood Product)' 등으로 일컬어지는 1세대를 시작으로, 유전자 조작 및 세포배양 기술을 도입한 '유전자 재조합 의약품', 나아가서 '세포융합 기술' 또는 '정보 기술' 등을 접목한 '단클론항체(Monoclonal Antibody)', '유전자 치료제(Gene Medicine)', '세포 치료제(Cell Therapy Products)', 'DNA 백신(DNA Vaccine)' 등과 같은 첨단 바이오의약품으로 발전해 나가고 있다.
- 1세대 바이오의약품: '1세대 바이오의약품'은 주로 박테리아와 효모 등의 미생물에서 추출한 단백질 치료제로, 미생물은 증식이 빠르고 대량배양이 쉬우며 배양 환경도 비교적 저렴하다.
- 2세대 바이오의약품: '2세대 바이오의약품'은 동물 세포를 이용한 항체의약품으로 분류되며, 1세대에 비해 복잡하고 거대한 분자구조를 가진다. 동물 세포에서 생산하기 때문에 성장 속도가 느리고 배양 환경 조절이 어렵다. 또한 배양기와 배양 배지의 가격이 높은 특징을 가져, 1세대 바이오의약품과 비교하면 고도화된 기술과 자본이 요구되어 개발의 불확실성이 높다.
- 3세대 바이오의약품: '3세대 바이오의약품'은 재생 의약품인 '세포치료제(Cell Therapy Products)'와 '유전자 치료제(Gene Medicine)'가 이에 속한다. 살아 있는 '자가 세포(Autologousc Cell)' '동종 세포(Allogenic Cell)', '이종 세포(Xenogenic Cell)'를 체외에서 배양·증식하거나 선별하는 등 물리적·화학적·생물학적 방법으로 조작하여 제조하는 의약품으로 '체세포 치료제', '줄기세포 치료제'가 이에 속한다. '유전자치료제'는 질병 치료 등을 목적으로 유전물질을 포함하고 있는 의약품으로 보다 근본적인 치료가 가능한 약제이며, '암', '신경퇴행성 질환', '유전질환' 등 난치성 질환 치료 목적으로 개발 중에 있다. '세포 치료제', '유전자 치료제' 개발 초기에 '체내 주입에 따른 부작용', '체내에서의 효과 미흡', '생명윤리와 관련된 이슈들' 등 상용화 과정에서 여러 어려움을 겪었으나, 최근 '세포 배양·조작 기술', '유전자 분석·조작 기술' 등의 발전으로 기술적 난제들이 해결되고 있다. 미국 FDA나 유럽 EMA에서 일부 제품들이 허가되며 시장 확대 중이다.
4. '바이오의약품'의 종류
'바이오의약품(Biomedicine)'의 종류에는 '유전자재조합 단백질', '세포치료제(Cell Therapy Products)', '유전자치료제(Gene Medicine)', '혈액 제제(Blood Product)', '백신(Vaccine)' 등이 있다.
- 유전자재조합 단백질: '유전자재조합', '세포배양', '단백질공학' 등의 기술을 기반으로 '미생물', '동물 세포'를 이용하여 대량 생산이 가능한 바이오의약품
- 세포치료제(Cell Therapy Products): 세포와 조직의 기능을 복원하기 위하여 살아있는 '자가 세포(Autologousc Cell)' '동종 세포(Allogenic Cell)', '이종 세포(Xenogenic Cell)'를 체외에서 배양·증식하거나 선별하는 물리적·화학적·생물학적 방법으로 특성을 조작하여 제조하는 의약품
- 유전자치료제(Gene Medicine): 질병 치료 등을 목적으로 결함이 있거나 결핍된 유전자를 대체하거나 수정하여 인체에 투입하는 의약품
- 혈액 제제(Blood Product): 인간의 혈액을 원료로 해서 만들어진 제제
- 백신(Vaccine): 인간을 비롯한 동물에 특정 질병 혹은 병원체에 대한 후천성 면역을 부여하는 의약품
| 바이오의약품의 종류 | 유효성분 | 종류 |
| 유전자재조합 단백질 | 유전자조작 기술을 기반으로 제조된 펩타이드 또는 단백질 | 성장 호르몬 항체의약품 바이오시밀러 |
| 세포치료제 | 체외에서 배양, 증식, 선별, 조작된 세포 | 체세포 치료제, 줄기세포 치료제 |
| 유전자치료제 | 질병 치료 목적의 유전자 도입 | DNA |
| 혈액제제 | 혈액성분 제제 및 혈액 분획 제제 | 적혈구, 혈소판, 혈장, 알부민 |
| 백신 | 적혈구 | 인플루엔자, 폐렴구균, 백신 |
4-1. 유전자재조합 단백질
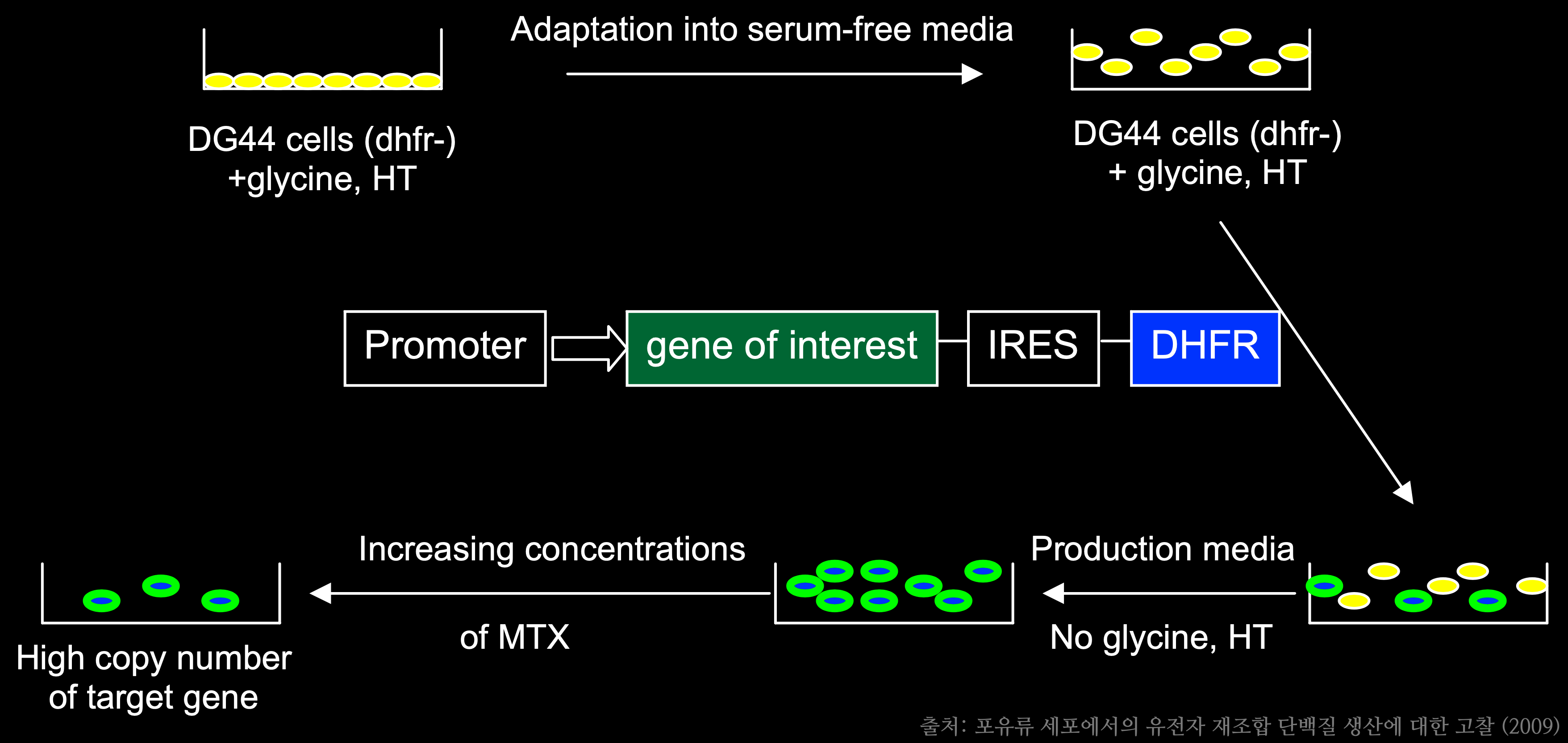
'유전자재조합 단백질'은 유전자 재조합 기술을 이용하여, 생체에서 충분히 얻기 힘든 치료용 단백질 성분을 대량생산한 의약품이다. '유전자재조합 단백질'은 표적 단백질을 코팅하는 유전자를 '발현 벡터(Expression Vector)'에 삽입한 후 '숙주세포(Host Cell: 미생물이 감염할 수 있는 세포)'를 활용하여 대량생산하는 것이 핵심으로, 이 중 유전자재조합 단백질 생산을 위한 고효율성 '세포주(Cell Line)'를 만드는 과정이 가장 중요하다. '세포주(Cell Line)'란 균일한 조직에서 유래된 세포의 집단으로, 동일한 유전적 특징을 가지는 세포의 계통을 의미한다.
최초의 '유전자재조합 단백질' 의약품은 '인슐린(Insulin)'이다. 이전에는 소와 돼지의 췌장에서 인슐린을 추출하여 치료제로 사용하였다. 하지만 소와 돼지의 인슐린은 사람의 인슐린과 아미노산 배열이 일부 달라, 주사 부위가 붉어지거나 항체가 생성되는 등의 부작용이 발생하였다. 이에 사람 인슐린을 대량으로 생산하기 위한 노력을 지속하여 '대장균', '효모' 등의 미생물에 사람 인슐린 생산 유전자를 삽입하여 원하는 단백질을 생산하게 하는 유전자 재조합 기술로 사람 인슐린을 대량으로 생산할 수 있게 되었다. 최초의 재조합 인슐린이 출시된 이후 '성장호르몬', '에리스로포이에틴(EPO: Erythropoietin)' 등 다수의 재조합 단백질 의약품이 출시되고 있다.
일반적으로 바이오의약품 시장에 시판 중인 치료 목적의 유전자재조합 단백질의 절반 이상은 포유류 세포를 활용하여 생산되고 있다. 미생물을 활용한 단백질 생산공정은 몇몇 단백 단백질들은 손쉽게 생산이 가능했지만, 실제 유용한 단백질은 생산하는 데 있어 제한점을 지니고 있다. '진핵 세포(Eukaryotic Cell)'에서 일어나는 '당화(Saccharification)' 등의 '단백질 번역 후 변형(Post-Translation Modification)'이 이루어지지 않아 실제 기능을 하는 단백질 생산이 불가능한 것이다. 이러한 이유로 포유류 세포를 활용한 생산 공정을 연구하게 되었고, 현재 'CHO Cell(Chines Hamster Ovary Cell)'이 가장 많이 활용되고 있다.
현재 '유전자재조합 단백질' 의약품 중 연구개발이 가장 활발한 분야는 '바이오시밀러(Biosimilar)'이다. 특히 선진국을 중심으로 특허가 만료된 단백질 의약품에 대한 바이오시밀러 개발이 활발히 이루어지고 있다. '바이오시밀러'는 특허가 만료된 오리지널 의약품을 대상으로 동일한 성분으로 만들어지는 바이오의약품이다. 2016년 유럽에서 치료용 단백질 바이오시밀러가 최초로 출시되었다. '항체의약품 바이오시밀러'는 블록버스터 제품 위주로 개발 중이며, '셀트리온(Celltrion)'이 국내 선두주자라고 할 수 있다. '셀트리온'의 '램시마(Remsima)'가 유럽시장에 시판 중이며, '트룩시마(Truxima)'도 유럽 EMA 허가 후 2016년에 판매를 개시하였으며, 2018년 초에는 '허쥬마(Herzuma)'의 유럽 판매를 시작하였다.
4-1-1. '유전자재조합 단백질'의 종류
'유전자재조합 단백질(Recombinant Protein)'은 '유전자재조합', '세포배양', '단백질공학' 등의 기술을 기반으로 '미생물', '동물 세포'를 이용하여 대량 생산이 가능한 바이오의약품으로, '치료용 단백질(Therapeutic Protein)', '항체의약품(Antibody drug)', '바이오시밀러(Biosimilar)', '바이오베터(Biobetter)'로 구분된다. 작용 기전 및 치료의 목적에 따라서는 '세포 조절 단백질', '면역 조절 단백질', '효소 및 저해제' 등으로 분류할 수 있다.
| 구분 | 정의 |
| 치료용 단백질 | - 인체 천연 단백질과 유사한 구조와 기능을 보유 - 인체 내의 부족한 유용 단백질 보충 |
| 항체의약품 | - 안정한 구조를 가진 항체 - 발병 기전에 관련된 단백질을 표적으로 함 |
| 바이오시밀러 | - 특허 만료된 의약품과 효능이 동등한 복제약 |
| 바이오베터 | - 기존 단백질의약품의 효능과 편의성 등을 개선한 신약 |
4-2. 세포치료제(Cell Therapy Products)
'세포치료제(Cell Therapy Products)'는 세포와 조직의 기능을 복원하기 위하여 살아있는 '자가 세포(Autologousc Cell)' '동종 세포(Allogenic Cell)', '이종 세포(Xenogenic Cell)'를 체외에서 배양·증식하거나 선별하는 물리적·화학적·생물학적 방법으로 특성을 조작하여 제조하는 의약품이다. 특정 질환의 치료에 살아있는 세포가 이용된 최초의 사례는 '수혈(Blood Transfusion)'과 '골수이식(Bone Marrow Transplant)'이었다. '세포치료제'는 1세대 바이오의약품인 '재조합 단백질 의약품'과 2세대 바이오의약품인 '단일클론항체(Monoclonal Antibody)'의 '짧은 약효', '적용 범위가 적은 한계점'을 극복하여 보다 근본적인 치료가 가능할 것으로 예측되고 있다. 세포치료제 기술은 '신약개발 효율화', '조직공학 및 바이오장기 개발' 등 다양한 분야에서 적용 가능한데, '치매(뇌 신경 세포)', '퇴행성관절염(연골 세포)', '당뇨(췌장 세포)' 등 다양한 만성 난치질환 영역에서의 치료제 개발이 활발히 이루어지고 있다.
'세포치료제(Cell Therapy Products)'는 그 기원에 따라 '줄기세포(Stem Cell)', '면역세포(Immunocyte)', '체세포(Somatic Cell)' 등으로 나눌 수 있다. 줄기세포는 다시 그 기원에 따라 '배아줄기세포(Embryonic Stem Cell)', '역분화 줄기세포(Induced Pluripotent Stem Cell)', '성체줄기세포(Adult Stem Cell)'로 분류되며, '면역세포'는 'T세포(T Cell)', '자연살해세포(NK Cell: Natural Killer Cell)', '수지상세포(Dendritic Cell)' 등으로 분류되며, '체세포(Somatic Cell)'는 '피부세포(Skin Cells)', '연골세포(Chondrocyte)' 등으로 분류된다.
'세포치료제(Cell Therapy Products)'의 핵심 기술은 '생산에 이용되는 줄기세포·체세포 등을 추출하는 기술', '세포주 확립기술', '분화 유도 기술', '대량생산기술', '안전성 제어기술'로 구성되며, '유전자치료제', '저분자 화합물 및 바이오의약품과 융합을 통한 병용치료 및 병용치료기술' 형태로 발전하고 있다. 이로 인해 '세포치료제' 시장은 '면역세포-유전자치료제', '면역세포-항체치료제' 등의 새로운 시장을 형성하고 있다.
최근 '세포치료제'는 인체의 면역력 조절을 통한 '면역세포치료제(Immune Cell Therapy)' 개발이 활발하게 이루어지고 있다. T 세포의 항암 면역 활성이 '면역 관문(Immune Checkpoints)'에 의해 조절된다는 사실이 밝혀지게 되면서, 항암제 개발 연구는 큰 전환점을 맞이하게 되었다. '면역세포제'는 크게 'T 세포(T Cell)', '자연살해세포(NK Cell)', '수지상세포(Dendritic Cell)'로 분류될 수 있다. 환자에게 직접 면역세포를 투여하여 면역기능을 활성화하여 치료 효과를 얻기 때문에, 향후 바이오 신약의 주요한 부분을 차지할 것으로 예상된다. 주로 암 치료를를 적응증으로 개발되고 있다. 면역세포치료제(Immune Cell Therapy)'는 환자의 면역세포를 외부에서 암세포를 인식할 수 있도록 조작하는 방식으로, 기존의 화학요법 항암제에서 나타나는 면역 세포 사멸로 인한 부작용을 최소화할 수 있다는 강점을 지닌다.
| 구분 | 세포치료제 종류 |
| 줄기세포 | 배아줄기세포 |
| 역분화줄기세포 | |
| 성체줄기세포 | |
| 면역세포 | T세포 |
| 자연살해세포 | |
| 수지상 세포 | |
| 체세포 | 피부세포 |
| 연골세포 |
4-3. 유전자치료제(Gene Medicine)
'유전자치료제(Gene Medicine)'는 질병 치료 등을 목적으로 결함이 있거나 결핍된 '유전자(Gene)'를 대체하거나 수정하여 인체에 투입하는 의약품이다. '유전자치료제(Gene Medicine)'는 치료 타겟 유전자를 병소에 이입하는 치료제로 유전자치료의 종류에는 체세포 위치에 정확히 전달되어야 한다. 유전자 전달을 위한 전달체로는 '아데노 바이러스(Adenovirus)', '레트로바이러스(Retrovirus)', '렌티 바이러스(Lentivirus)', '아데노부속바이러스(AAV: Adeno-Associated Virus)', '헤르페스 바이러스(Herpes Virus)', '리포솜(Liposome)' 등이 이용되고 있다. '유전자치료제(Gene Medicine)'는 '치료용 유전자'와 '유전자전달체인 '벡터(Vector)'로 구성되며, 전달 방식에 따라 'in vivo', 'ex vivo'로 구분된다.
- in vivo: 표적 세포 및 조직에 치료 유전자를 직접 주입하는 방법으로 환자의 세포를 채취하고, 유전자가 도입된 세포를 다시 몸속으로 넣어주는 번거로운 과정이 불필요하다. 하지만 표적 이외의 세포나 조직에서 발현되어 '오프 타깃 효과(Off-Target Effect)'가 발생할 가능성이 있으며, 면역 반응에 의해 표적 세포에 도달하기 전에 제거될 가능성이 있다.
- ex vivo: 체외에서 표적세포에 유전자를 도입하여 형질 전환시켜 선별 후, 증식시켜 대상 조직에 삽입하는 방법이다. in vivo 방식에 비해 유전자 전달이 용이하며 '오프 타깃 효과(Off-Target Effect)'와 면역반응에 의해 제거되는 확률을 줄일 수 있다. 형질 전환된 세포에 대해 선별, 증식, 품질평가가 가능하여 안정성이 확보될 수 있다는 것 또한 장점이다.
'유전자치료제'는 생명공학 기술발전에 따라 과거에는 치료가 불가능하다고 여겨졌던 질병들을 정복해 나가는 것을 가능하게 함으로써, 인류에 기여하는 바가 크다. '패스트 트랙(Fast Track)'과 '희귀 의약품', '혁신 의약품', '우선 심사' 등을 통해 임상 기간 단축이 가능하며 One-Shot Therapy로 효능이 지속되어 보다 근본적인 치료가 가능하다는 강점을 가진다.
'지단백 분해 효소 결핍증' 치료제인 Glybera의 2012년 유럽 판매 승인 후, 세계적으로 유전자치료제의 개발 성과가 가시화되어 지속적으로 성장해 왔다. 하지만 효율적인 생산시설의 확보가 어려워 높은 약가를 형성하고 있으며, 환자 수가 적은 경우 매출액이 미미할 가능성이 존재한다. 또한 2018년에 중국의 연구자 '허젠쿠이(賀建奎, 1984~)'가 인간배아 유전자 편집 실험이 성공했다는 논문을 발표함에 따라, 유전자 편집과 관련된 사회적 논쟁이 본격화되었다.
4-4. 백신
'백신(Vaccine)'은 질병에 대한 면역력을 높이고자 면역체계에 인위적으로 항원을 주입하여 선택적으로 질병을 예방하는 치료제이다. 목적에 따라 '예방용', '치료용'으로 나뉘고, 항원의 수에 따라 '1가 백신(Monovalent Vaccine)', '다가 백신(Polyvalent Vaccine)'으로 구분되고 있다. 백신은 공공재적 성격이 강해 정부가 수요처이다.
- 약독화 백신(Attenuated Vaccine): 질병 유발 미생물을 약화시켜 인체 내에 주입하는 백신
- 불활성화 백신(Inactivated Vaccine): 질병 유발 미생물을 화학제 또는 열처리하여 불활성화한 백신
- 유전자재조합 백신(Recombinant Vaccine): 질병 유발 미생물로부터 항원 유전자를 분리 후 원하는 항원만을 생산하는 형태의 백신
- 변성독소 백신(Toxoid Vaccine): 간질병 유발 미생물이 생산하는 독소에 대해 대항하는 항체르 유도하는 백신
- 다당 백신(Polysaccharide Vaccine): 질병 유발 미생물의 세포벽 주성분인 다당을 추출하여 제조한 백신
성공적인 백신의 접종은 두 가지 면역 효과를 획득할 수 있다. '체액성 면역(Humoral Immunity, Antibody-Mediated Immunity, 항체 매개)'과 '세포성 면역(Cellular, Cell-Mediated Immunity)' 반응이다. 즉 '체액성 면역'뿐만 아니라, '세포성 면역' 모두를 유도하게 하는 것이 백신 접종의 목표이다. '체액성 면역'은 일반적으로 알고 있는 것처럼 백신을 맞게 되면 항체가 생겨나서 다음에 그 병원체의 침입이 있게 될 때 즉각 대응할 수 있는 능력이다. 한편 '세포성 면역'은 해당 병원체를 항원으로 기억하고 있으면서 병원체의 침입이 있을 시, 식세포작용과 염증 유발 물질인 '싸이토카인(Cytokine)'을 방출하여 직접적으로 병원체를 공격하는 T 림프구의 작용을 유발하는 면역이다.
5. 신약개발
글로벌 의약품 시장은 '소득수준 증가', '고령화'에 따른 만성질환자 수의 증가에 따른 의료비 지출 증가 등으로 큰 성장이 기대된다. 바이오의약품은 독성이 낮고, 작용 기전에 따른 선택적 작용이 가능한 특징을 가지고 있다. 그래서 난치성 및 만성질환에 대한 치료 효과가 커서, 점차 시장 비중이 확대되고 있으며 향후 제약시장의 성장 동력으로 자리매김하고 있다. 이에 따라 국내외 제약사들의 투자 역시 증가하고 있는 추세이다.
바이오의약품 개발 업체들은 막대한 자금을 투자하여 '생산시설 확장', '파이프라인 확대', '공정기술 개선', 'GMP 인증' 등 연구개발 역량을 강화해왔지만, 여전히 시장 진입에 대한 불확실성이 존재한다. 바이오의약품은 의사와 환자들의 '유효성 및 안전성에 대한 우려', '처방을 위한 관련 법안 및 가이드라인의 미비', '각종 규제' 등으로 시장 활성화의 제한 요인'으로 작용하고 있다. 특히 '임산 진입 후 실패 확률' 역시 중요한 제한 요인이라고 볼 수 있다.
5-1. 신약개발 프로세스
전반적인 신약개발 프로세스는 다음과 같은 순서로 진행된다.
- 기초 탐색 및 원천기술 연구 과정
- 개발 후보물질 선정 단계
- 전임상(비임상) 시험 단계
- 임상시험(Clinical Trial) 과정
- 신약 허가 및 시판
바이오의약품 개발과정에서 막대한 R&D 자금이 필요하며, 임상 단계에서는 임상 연구비 전체의 70%가 3상에 집중되어 있다. 전 임상 단계를 통과하고 판매 승인을 받기까지 짧게는 10년, 후보물질 발굴 단계까지 포함하면 최소 15년 이상의 시간이 소요된다. 하지만 상당한 자금과 시간을 투자하고도 상용화에 실패하는 경우가 대부분이다. 미국 바이오협회에 따르면, 2006년부터 2015년까지 FDA 9985건의 임상 자료를 분석한 결과, 바이오의약품 후보물질이 임상 1상부터 품목승인까지 전 과정을 통과할 확률은 10% 이하인 것으로 나타났다. 전임상 단계에서 실패하는 후보물질까지 포함한다면 성공 확률이 1% 정도 수준에 그친다.
5-2. 한국의 신약 개발
신약 개발 단계에서 실패는 당연히 거쳐야 하는 통과의례라고 볼 수 있다. 많은 시간과 자원을 투입하고도 실패할 경우 기회비용이 매우 큰 것은 부정할 수 없다. 그럼에도 불구하고 바이오의약품 산업이 새로운 성장 동력인 것은 부인할 수 없는 사실이다. 바이오의약품으로 패러다임이 전환되면서 R&D 비중은 지속적으로 증가하고 있으며, 향후 개발과정에서는 실패 확률이 더욱 더욱 증가할 수 있음을 의미한다. 결국 효율적인 R&D 인프라를 구축하여 바이오산업이 지속 가능한 기술혁신의 기반을 마련해야 할 것이다. 이를 극복하기 위해 국내외 제약사들은 '폐쇄형 혁신' 전략에서 벗어나 '외부의 기업 연구소'나 '대학' 등으로부터 기술과 노하우를 적극적으로 활영하는 '개방형 혁신' 전략을 도입하고 있다. 현재 국내의 많은 바이오기업들이 해외 임상시험을 진행하고 있으며, 글로벌 시장의 새로운 강자로 부상하고 있다. 이에 따라 '라이선스 아웃(License-Out)'을 활용한 '외향형 혁신'의 기회가 증가할 것으로 전망된다.
기존에 국내 바이오제약 산업의 성장이 더뎠던 이유는 전통적인 제조업처럼 내수시장을 기반으로 성장하겠다는 생각이 자리하고 있었기 때문이다. 하지만 이제는 많은 바이오의약품 개발자들이 이러한 고정관념을 부수고, 글로벌 시장을 목표로 연구개발을 진행하고 있으며 괄목할 만한 성과를 이루고 있다. 정부에서도 인식을 전환하고 바이오의약품 산업의 육성을 위한 전략을 수립하고, 바이오의 약품 5대 핵심 기술 분야를 선정하고 'R&D 투자 확대', '인프라 조정', '제도 개선', '글로벌 사업화 촉진' 등에 대한 다양한 정책적 지원안을 마련하고 있다.
6. 대한민국의 신성장동력 '바이오의약품' 산업
과거 한국의 경제를 지탱했던 제조업의 산업 경쟁력은 지속적으로 약화되고 있다. '산업연구원(KIET: Korea Institute for Industrial Economics & Trade)'의 통계자료에 따르면 2011년~2017년, 6년 동안 자동차·조선·철강·통신·디스플레이·섬유 등의 업종에서 수출이 둔화되는 현상을 보이고 있다. 다만, 이중 유일하게 반도체만이 수출 증가 양상을 보이고 있으며, 국내 수출 구조는 반도체 의존적인 방향으로 진행되어 왔다. 이처럼 국내 경제를 주도해온 주력산업들이 추진력을 일게 되면서, 새로운 혁신 산업의 육성이 필요하다는 주장이 꾸준히 제기되어 왔다. 이에 따라 2018년 대한민국 정부는 미래 자동차, 드론, 에너지, 바이오헬스, 스마트 공장, 스마트시티, 스마트 팜, 핀테크를 혁신성장 8대 선도산업으로 선정하였다. 주목할 부분은 '8대 선도 산업'에 바이오의약품이 포함되어 있는 '바이오헬스'가 새롭게 선정되었다는 것이다.
그동안의 지속적인 투자와 연구개발로 바이오의약품은 점차 가시적인 성과가 나타나고 있어, 새로운 성장 동력 산업으로 주목받고 있다. 식품의약품안전처에 따르면, 바이오 의약품 생산은 2013년~2017년, 5년간 8.7% 증가했으며, 수출액은 연평균 35.6% 증가한 것으로 나타났다. 또한 2015년부터 수출액이 수입액을 넘어서면서, 점차 글로벌 경쟁력을 갖춰 나가고 있는 것으로 확인되었다. 이처럼 국내 기업들은 '바이오시밀러'를 시작으로 '바이오베터', '면역항암제', '세포치료제' 등 3세대 바이오의약품에 이르는 지속적인 혁신을 거듭해왔다. 국내 기업들의 적극적인 연구개발로 바이오의약품은 대한민국의 경제를 이끌어갈 혁신 산업으로 자리 잡을 기반이 마련되었다.
주력산업의 위기 속에서 바이오의약품 산업의 육성은 이제 국내 경제의 새로운 도약을 위한 선택이 아닌 필수사항이다. 바이오산업이 대한민국 경제의 성장 동력으로 확실히 자리매김하기 위해서는 적극적인 투자와 인프라의 혁신이 필요하다. 바이오의약품 산업의 육성을 위해서는 '헬스케어(Health Care)', '정밀 의료(Precision Medicine)' 등 혁신의 주체인 대학·기업·병원 등이 초기 시장 형성이 가능하도록 규제 및 보완 장치를 균형 있게 개편하는 노력이 필요하다. 아울러 정부화 사회 차원의 인식 전환과 함께 시스템적 혁신이 수반되어야 한다.
7. '바이오의약품' 관련 기업
글로벌 제약기업들은 바이오의약품의 파이프라인을 확대하기 위해 '자체 개발', '기술이전', 'M&A' 등 중소·대형 제약사 간의 전략적 파트너링을 체결하는 움직임이 확산되고 있다. 대형 제약사들을 위주로 블록버스터 바이오의약품의 특허만료가 본격화됨에 따라 '바이오시밀러' 연구 개발을 가속하고 있다. 2021년 기준, 바이오의약품 시장의 약 70% 이상을 바이오의약품 매출 상위 10대 기업인 '로슈(Roche)', '머크(Merck)', '사노피(Sanofi)', '암젠(Amgen)', '존슨앤존슨(Johnson & Johnson)', '일라이 릴리(Eli Lilly)', '노보 노디스크(Novo Nordisk)', '애브비(AbbVie)', '브리스톨-마이어스 스퀴브(Bristol-Myers Squibb)', '화이자(Pfizer)' 등이 차지하고 있다. 2022년 기준 바이오의약품 매출액 1위 기업은 '맙테라', '허셉틴', '아바스틴' 등 다수의 블록버스터급 바이오의약품을 보유한 '로슈(Roche)'였다. '바이오의약품 신약개발 파이프라인 증가'와 '글로벌 제약사들의 매출 비중 변화'는 공급 측면에서도 제약산업의 무게중심이 바이오의약품으로 이동하고 있다는 것을 보여주는 중요한 지표가 되고 있다.
2023년 이후 글로벌 제약기업들의 M&A 거래 건수와 규모는 증가하는 추세이다. 2018년 세계 제약·바이오 산업 M&A 거래 건수는 1438건으로 전년 대비 23% 상승하였고, 거래 규모 또한 3400 달러로 20년 내 최고치를 기록하였다. 이는 글로벌 제약기업들이 외부 자원을 활용함으로써 내부 혁신 비용과 기회 비용 등을 절감하고 '기술자산 매각', '스핀 오프(Spin-off)', '라이센싱 인/아웃(Licensing In/Out)' 등을 통한 신규 매출을 창출하는 한편, 신규 동력 확보를 위해 '오픈 이노베이션(Open Innovation)' 성장 전략을 추구한 결과로 생각해 볼 수 있다. 최근 M&A는 항암제, 희귀의약품 등 '차세대 바이오의약품 파이프라인 확대', '디지털 기술을 접목한 유전체 분석', '정밀의료' 부문을 중심으로 이루어지고 있다. 세계동향에 맞춰 한국의 기업 또한, 국내외 제약기업들과 'M&A' 및 '라이센싱 인/아웃(Licensing In/Out)'을 통해 미래시장 개척을 위한 경쟁력을 키워나가고 있다.
7-1. 메디톡스(Medytox)
- 국적: 한국
- 설립: 2000년
'메디톡스(Medytox)'는 'A형/B형 보톨리늄 톡신 단백질 치료제 생산업', '단일클론항체 생산업', '재조합 단백질 생산업', '연구개발 및 연구개발 용역업'을 영위하고 있으며, 2009년에 코스닥 시장에 상장되었다. '메디톡스(Medytox)'는 연결대상 종속회사로 의약품 기업인 '메디톡스 코리아(Medytox Korea)' 등 국내 및 일본의 소재 회사 5개사를 보유하고 있다.
'메디톡스'의 주력 제품은 얼굴 피부의 주름 완화 성분인 보툴리눔 톡신 제재 의약품인 '메디톡신주'로, 2006년 출시 이후 메디톡스는 높은 성장세로 성장하여, 2009년 이후 40%에 가까운 높은 시장점유율을 기록하였다. 이를 바탕으로 생체친화적인 '히알루론산을 이용한 필러', '독소 진단키트', '항독소 치료제' 개발 등 다양한 분야의 연구기술을 발굴 및 확장하고 있다.
7-2. 휴젤(HUGEL)
- 국적: 한국
- 설립: 2001년
'휴젤(HUGEL)'은 '생물학적 제제의 제조 및 판매'와 '의학 및 약한 연구개발업'을 주요 사업으로 영위하고 있는 기업으로, 2015년에 코스닥 시장에 상장되었다. '휴젤'은 '보툴리눔 톡신 제제(Botulinum Toxin Preparation)', '히알루론산 필러(Hyaluronic Acid Filler)', 'PDO 실', '바이오 코스메틱(Bio Cosmetic)' 등의 주요 제품군을 보유하고 있다. '휴젤'의 보튤리눔 톡신 제제 '보툴렉스(Botulax)'는 미간 및 눈가 주름 개선 등 성형시술 외에 소아 뇌성마비, 요실금, 다한증 경부근긴장 이상 등으로 적응증을 확대하고 있으며, 국내 최초 대만 시판허가 획득을 취득하여 판매를 진행하고 있다. 특히 '휴젤'은 차세대 보툴리눔 톡신 개발을 위한 제형 다양화에도 힘을 쏟고 있다. 분말형 보툴렉스를 액상 형태로 바꾼 연구개발법인 2018년 11월에 특허 기술로 인정받았고, 2019년 1월에는 '마이크로 구조체(Microstructure)'를 통해 정량의 톡신을 정확한 위치에 투여할 수 있는 '마이크로 구조체 제형화' 관련 특허 등록을 완료했으며, 패치형 톡신도 개발 중에 있다.
점성 및 탄성이 향상된 BI-HEXA 공법이 적용된 '히알루론산 필러(Hyaluronic Acid Filler)'인 '더 채움'은 2017년 남성 비뇨기 필러 식약처 품목허가를 획득하여 주름 치료 및 음경 확대 목적으로 사용되고 있다. 또한 식품의약품안전처와 유럽의 '유럽 의약품 품질위원회(EDQM: European Directorate for the Quality of Medicines & Healthcare)'의 인증을 받은 고품질 히알루론산을 사용한 미세입자 균일화 공법을 적용한 '더 채움 스타일'도 출시하여 상용화하였다. 이와 같은 실적을 바탕으로 2020년 기준, 톡신 및 필러 한국 시장 점유율 1위를 하며 미용·치료 시장에서 선도적 자리를 지키고 있다.

7-3. 헬릭스미스
- 국적: 한국
'헬릭스미스(Helixmith)'는 1996년에 서울대학교 학내 벤처로 설립되었으며, 플라스미드 DNA 플랫폼을 이용한 유전자 치료제를 개발하는 바이오신약 사업과 천연소재의 약효를 검증하는 천연물 신약 사업을 영위하고 있다. 2005년 코스닥 시장에 상장된 국내 1호 기술 특례 상장기업이다.