우리는 주변에서 약을 아주 흔하게 볼 수 있어서, 약이라는 것이 쉽게 만들어진다고 생각할 수도 있다. 그러나 실제로는 하나의 '의료용 의약품(처방전 의약품)'을 만들기 위해 걸리는 연구 개발 기간은 약 15~20년, 그리고 거기에 들어가는 비용은 평균 8000억 원이 넘는다고 한다. 전 세계적으로 수백 개나 있는 제약 회사가 총력을 기울여 연구하고 있는데도 불구하고, 1년 동안 승인되는 식약의 수는 세계적으로 단지 15~20종에 불과하다. 약을 만드는 과정은 왜 이 정도로 어려운 것일까? '신약 개발(New Medicine Development)'의 세계를 들여다보자.
0. 목차
- '병의 원인' 알아내기
- '약의 씨앗' 찾기
- 부작용 줄이기
- 임상 실험
- 시판 후 임상 시험
- 미래의 신약
1. '병의 원인' 알아내기
약을 만들려면 먼저 그 질병의 원인을 알아내야 한다. 예컨대 '인플루엔자(influenza)'를 치료하기 위해서는 인플루엔자의 원인이 무엇인지 알아야 대책을 세울 수 있다. 인플루엔자는 '인플루엔자 바이러스(influenza virus)'가 '기관(Organ)' 등의 세포에서 증식함으로써 발병한다. 따라서 바이러스 증식에 관여하는 단백질의 기능을 억제함으로써, 인플루엔자 증상을 완화시킬 수 있다고 추정된다. 현재, 바이러스 증식에 관여하는 3종의 단백질의 작용을 억제하는 약이 각각 승인되었다.
- 첫째는 바이러스가 가지고 있는 'M2'라는 단백질의 기능을 억제하는 것이다. M2는 바이러스가 자신의 유전 정보가 쓰여 있는 분자를 세포 안으로 방출할 때 사용된다. 이 단백질을 방해함으로써 바이러스의 증식을 막는다.
- 둘째는 바이러스의 RNA를 새롭게 합성하는 단백질의 기능을 방해하는 것이다. 이 약의 효력으로 바이러스는 새롭게 RNA를 만들지 못하며, 결과적으로 증식을 억제할 수 있다.
- 셋째는 바이러스가 세포 밖으로 나가기 위해 필요한 단백질의 기능을 억제함으로써, 바이러스의 증식을 막는 것이다. '타미플루(Tamiflu)'나 '리렌자(Relenza)'는 이 작용을 하는 약이다.
질병의 원인을 찾아 목표가 되는 단백질을 찾는 '병리학(Pathology)'과 '신약개발(New Medicine Development)'은 뗄 수 없는 관계에 있다.
2. '약의 씨앗' 찾기
약의 표적이 되는 단백질은 '열쇠'와 '열쇠 구멍'의 관계에 있다. 따라서 표적이 되는 단백질이 정해지면, 다음은 그 단백질에 꼭 들어맞는 '열쇠'가 되는 화합물을 찾는 단계에 들어간다.
2-1. 고속 대량 스크리닝
'열쇠의 근본이 되는 화학물(약의 씨앗)'을 찾기 위해서 각각의 제약 회사는 수백만 종에 이르는 화합물을 '화합물 라이브러리'를 가지고 있다. '화합물 라이브러리(Compound Library)'는 인공적으로 합성된 화합물을 '합성 화합물 라이브러리'와 식물, 세균, 버섯, 곰팡이 등 천연물에서 발견된 화합물을 모은 '천연 화합물 라이브러리'로 구성된다. 이러한 다종다양한 화합물을 하나씩 빼내어 표적이 되는 단백질과 같은 용액 안에 섞어, 각각의 화합물이 얼마나 단백질과 강력하게 결합하는지, 즉 열쇠의 역할을 하는지를 조사할 수 있다.
현재 이 작업은 거의 자동화되어 있으며, 고속으로 이루어진다. 그 속도는 1주일에 수만 종의 화합물을 검사할 수 있을 정도라고 한다. 약의 후보를 좁혀나가는 이 작업을 '고속 대량 스크리닝(HTS: High-Throughput Screening)'이라고 한다. 즉 '고속 대량 스크리닝'은 로봇을 이용해 방대한 종류의 화합물 중에서 '약의 씨앗'을 추려나가는 기술이다. 아래의 사진에서는 수십 종의 화합물을 한 번에 검사하는 모습을 그렸다. 상부의 액체에는 각각 다른 화합물이 포함되어 있으며, 하부에는 표적이 되는 단백질이 포함되어 있다. 화합물과 단백질이 결합했는지를 확인하는 방법은 여러 가지이다. 예컨대 화합물과 결합한 단백질만 빛을 내게 처리함으로써 단백질과 화합물의 결합 정도를 측정할 수 있다.
- 천연 화합물 라이브러리(Natural Compound Library): '천연 화합물 라이브러리'는 식물이나 세균 등의 천연물에서 발견된 다양한 분자 구조를 가진 화합물을 모은 것이다. 일반적으로 천연물이 가진 분자는 매우 복잡한 모양을 하고 있다. 현재도 천연물 유래의 화합물로 만들어진 약은 40% 정도를 차지한다. 또 최근에는 천연 화합물을 합성하는 효소군을 이용함으로써, 천연 화합물을 인공적으로 합성하는 연구도 이루어지고 있다. 예컨대, 2011년에 일본의 제약 회사 '에자이'에서 판매한 항암제 '에리불린(상품명: 할라벤)'은 주로 바다에 서식하는 원시적인 생물인 '해면'에서 발견된 '할리콘드린B'라는 매우 복잡한 화합물을 토대로 만들어졌다.
- 합성 화합물 라이브러리(Synthetic Compound Library): '합성 화합물 라이브러리'는 인공적으로 합성된 다양한 분자 구조를 가진 화합물을 모은 것. 현재는 '조합 화학(Combinatiorial Chemistry)'라고 불리는 방법으로 많은 화합물을 한 번에 합성할 수 있게 되었다.

3. 부작용 줄이기
'고속 대량 스크리닝'으로 '약의 씨앗'을 얻었다고 해서 그것이 바로 약이 되는 것은 아니다. 부작용을 줄이기 위해서는 추가 연구가 필요하다. 부작용이 강한 약이라고 하면 '항암제(Anticancer Drugs)'를 떠올릴 것이다. '항암제'는 암세포가 늘어나는 것을 억제하거나 암 조직의 성장을 늦춘다. 예컨대 오래전부터 사용되어 왔던 항암제에 '플루오로우라실(Fluorouracil)'이란 것이 있다. 이 약은 암세포의 핵으로 들어가 'DNA에서 DNA를 복제하는 과정'이나 'DNA에서 RNA를 만드는 과정(전사 과정)'을 방해함으로써 암세포를 사멸시키는 작용을 한다.
3-1. 환부에만 작용하도록 약을 설계한다.
그러나 약은 기본적으로 온몸에 퍼진다. 따라서 이처럼 항암제는 암세포 이외의 정상적인 세포의 증식까지도 억제한다. 그 결과, 설사, 탈모, 빈혈 등의 부작용이 생기는 것이다. 그러면 어떻게 하면 암세포에만 약제의 효력을 발휘하게 할 수 있을까? '카페시타빈(Capecitabine)'이라는 항암제를 예로 그 방법을 보자. '카페시타빈'은 그 모양 그대로는 세포의 증식을 억제하는 작용을 하지 않는다. 소장에서 흡수된 카페시타민은 간의 효소로 인해 '독시플루리딘(Doxifluridine)'이라는 분자로 바뀐다. '독시플루리딘'도 세포의 증식을 막는 기능은 없다. '독시플루리딘'은 암세포 안에 들어가면, 암세포에 많이 존재하는 효소로 인해 '플루오로우라실(Fluorouracil)'로 변한다. 그리고 처음으로 세포 증식을 억제하는 효과를 나타내게 된다. 암세포 이외의 세포에서는 거의 플루오로우라실의 모양이로는 변하지 않기 때문에, 부작용을 줄일 수 있는 것이다.
이처럼 몸속에서 약물 분자가 변함으로써, 처음으로 약효를 나타내는 약을 '프로드러그(Prodrug)'라고 한다. 항인플루엔자약인 '오셀타미비르(Oseltamivir)'나 해열 진통제 '록소프로펜(Loxoprofen)'도 '프로드러그(Prodrug)'이다.
3-2. 드러그 딜리버리 시스템
'프로드러그(Prodrug)'와는 전혀 다른 방법으로 부작용을 줄이려는 연구도 있다. 항암제를 매우 작은 용기인 '나노 캡슐(Nano Capsule)'에 담아서 암세포로만 약을 운반하는 방법이다. 이처럼 목표 조직에만 약을 운반하는 방법을 '드러그 딜리버리 시스템(DDS: Drug Delivery System)'이라고 한다.
왜 약을 캡슐에 담는 것만으로 암세포로 전달할 수 있을까? 혈관은 '내피 세포(Endothelial Cell)'라는 세포로 만들어졌다. 그리고 내피 세포와 내피 세포가 이웃한 틈 사이에는 영양분 효소가 출입할 수 있도록 작은 구멍이 열려 있다. 약물은 이 구멍을 지나감으로써 세포에 도달할 수 있다. 그러나 이 작용은 부작용이 나타나는 원인이기도 하다. 항암제는 이 틈새를 통과하기 때문에 정상적인 세포에도 항암제가 들어가고, 그 때문에 부작용이 생기는 것이다. 그런데 항암제를 캡슐로 싸면, 전체 크기가 커지기 때문에 캡슐이 틈새를 지나갈 수 없다. 그 결과, 세포에는 항암제가 전해지지 않으므로 부작용이 생기지 않는다. 한편, 암세포 주위의 혈관은 이 틈새가 크게 벌어졌다는 특징이 있다. 그래서 캡슐은 암세포 주위의 혈관에서 흘러나와 항암제를 암세포에만 도달시켜 부작용을 가능한 한 줄일 수 있다.
또 캡슐에서 약물이 조금씩 방출되도록 개발해 투여 횟수를 줄이는 것도 가능하다. 또 최근에는 캡슐 안에 항암제 뿐만 아니라 '핵산(DNA나 RNA)'을 담아, 목표로 하는 장기까지 운반하여 치료할 수 있는 '핵산 제제'의 연구도 진행 중이다.
4. 임상 시험
지금까지 설명한 연구를 통해 '약의 씨앗'이 되는 화합물을 얻었다고 치자. 그러나 이 화합물이 의약품으로 판매되기까지는 또 다른 과정들을 거쳐야 한다. 개발된 화합물들은 먼저 생쥐나 개 등의 동물을 이용한 '안전성 시험(독성 시험)'이나 약물이 몸속에서 어떻게 퍼지는지에 관한 '약물 동태 시험'을 거친다. 이러한 시험을 '전 임상 시험(Preclinical Trial)'이라고 한다.
'전 임상 시험'에서 안정성에 문제가 없다고 확인된 경우, 사람에게 약효가 나타나면 또 부작용이 있는지 없는지를 확인하는 시험을 한다. 이 검증을 '임상 시험(Clinical Trial)'이라고 한다. 임상시험은 3단계로 나누어지는데, 각각 '제1상 시험(Phase Ⅰ)', '제2상 시험(Phase Ⅱ)', '제3상 시험(Phase Ⅲ)'이라고 한다. '제1상 실험'에서는 건강한 사람을 대상으로 소량으로 시작해 조금씩 화합물의 투여량을 늘려 안정성에 관한 조사를 한다. 다음의 '제2상 실험'에서는 수십 명의 가벼운 증상의 환자를 대상으로 유효성, 안정성, 투여량 등을 조사한다. 그리고 마지막 개발 단계인 '제3상 실험'에서는 수백 명에서 1000명을 넘는 많은 환자에 대해 더욱 자세한 유효성과 안전성을 확인한다. 이러한 임상 시험으로 기존의 약보다 우수한지를 정밀하게 조사하고, 그 결과 유효성이 있다고 국가의 인정을 받은 경우 드디어 시중에 판매될 수 있다.
지금까지 설명한 신약 개발의 과정을 정리해 보면 다음과 같다. 병의 원인을 알아내고, 약의 씨앗을 찾고, 부작용을 줄이고, 전 임상 시험 과정을 거치고, 임상 시험을 거치고, 국가의 인정을 받는 과정을 거친다. 이 과정을 모두 거쳐 신약이 완성되기 까지는 대략 15~20년의 세월과 대략 수천억 원의 비용이 든다. 앞으로의 생명공학 기술의 발전에 의해, 이 기간은 더 짧아지거나 비용이 줄어들 수도 있다.
- 병의 원인 알아내기: 표적을 정한다.
- 약의 씨앗 찾기: '약의 씨앗'을 탐색한다.
- 부작용 줄이기: 부작용을 주이고, 화합물을 최적화한다. 이 단계에서 의약품 후보가 완성된다. 이 과정까지 모두 합치면 2~3년 정도 걸린다.
- 전 임상실험(3~5년): 동물을 대상으로 한 안전성 평가이다. 독성, 의존성, 발암성 등의 문제가 없는지 조사한다.
- 임상 시험(3~7년): 건강한 성인과 환자에 대해 의약품 후보를 투여한다.
- 신청 승인(1~2년): 기존의 약보다 우수하다고 인정되는 경우, 신약으로 승인된다.
4-1. 임상 시험에는 '오랜 시간'과 '막대한 비용'이 든다.
아래의 그래프는 여러 나라에서 개발한, 임상 시험까지 도달한 '약의 씨앗'이 다음 시험 단계로 얼마나 올라가는지를 나타낸 것이다. '제1상 시험'에서 '제2상 시험'으로 올라갈 때 40% 정도가 탈락하고, 또 '제2상 시험'에서 '제3상 시험'으로 올라갈 때 60% 정도가 탈락한다. 최종적으로 약이 되는 것은 제 1상 시험에 들어간 화합물 가운데 8% 정도에 불과하다. 방대한 수의 화합물 중에서 '약의 씨앗'이 되었는데도 불구하고, 실제 의약품으로 인가받는 것은 그중에서도 극히 일부인 셈이다.

4-2. 마이크로도즈 임상 시험
임상 시험에는 오랜 시간과 막대한 비용이 든다. 신약 개발 연구 전체에 들어가는 비용 중 태반은 임상 시험 때 발생한다. 즉, 임상 시험에서 탈락하는 화합물을 줄일 수 있다면, 신약 개발 전체에 드는 시간과 비용을 줄일 수 있다. 그래서 현재 임상 시험 전에 하는 시험으로 '마이크로도즈 임상 시험'이라는 방법이 연구되고 있다. '마이크로도즈 임상 시험(Microdose Clinical Trial)'이란 약효가 나타날 것이라고 예상되는 투여량의 100분의 1을 넘지 않는 미량의 화합물을 건강한 사람에게 투여해 이 화합물이 몸속에서 어떻게 퍼지고 배설되는지를 조사하는 실험이다. 투여량이 매우 적기 때문에, 부작용이 일어날 위험성이 거의 없다는 장점이 있다. 앞으로 '마이크로도즈 임상 시험'을 이용함으로써, 제1상 시험에 드들어간 화합물이 의약품으로 인가받는 성공률이 30% 이상까지 올라갈 수도 있다.
4-3. 나라에 따라서 사용할 수 없는 약이 있는가?
'드러그 래그(Drug Lag)'라는 말이 있는데, 이 말은 나라에 따라서 신약을 사용할 수 있는 시기가 다르다는 것을 의미한다. 'Lag(래그)'는 '지체', '지연'이라는 뜻이다. 예컨대 2010년에 승인된 의약품의 경우, 제1상 시험'에서 승인되어 판매되기까지 걸린 평균 시간이 미국 1,9년, 영국 1.2년, 독일 1.3년, 일본 4.7년으로 나타났다. 이처럼 일본은 다른 나라와 비교해 신약의 승인이 늦어지는 경향이 있는데, 이는 임상 시험을 시작하는 시기가 늦거나 임상 시험에 걸리는 시간이 길기 때문이라고 한다.
그래서 임상 시험을 여러 나라에서 동시에 하는 '다국가 공동 임상 실험'에 적극적으로 참여함으로써 약의 개발과 승인 신청을 외국과 동시에 하려는 시도도 이어지고 있다. 이러한 시도를 통해 임상 시험을 시작하는 시기를 앞당길 수 있다. 또 시험의 심사를 맡는 심사 위원의 수를 늘림으로써 승인 심사 시간을 단축하려는 움직임도 있다.
4-4. 제네릭 의약품
'제네릭 의약품(Generic Medicine)'이란 '특허가 끝난 의약품'의 유효 성분을 이용해 다른 제약회사가 개발한 것이다. 과거에는 '제네릭 의약품'을 '카피약' 또는 '복제약'이라고도 불렀다. '제네릭 의약품'은 '오리지널 의약품'에 비해 개발비가 적기 때문에, 오리지널 의약품에 비해 가격이 저렴하다는 장점이 있다. '제네릭 의약품'의 유효성에 대해서는 제약 회사에서 다양한 시험을 하고 있으며, 그에 따라 오리지널 의약품과 효력이 같다고 인정되는 약만 국가에서 제네릭 의약품으로 승인을 받는다.
한편, '제네릭 의약품'에는 주의해야 할 점도 있다. '제네릭 의약품'의 성분을 보면 '유효 성분'은 같지만 그 이외의 성분은 다른 경우가 있다. 약에는 유효 성분뿐만 아니라 약제를 안정시키거나, 약제의 냄새를 없애기 위해 많은 첨가물이 포함되어 있다. 그런데 이러한 첨가물에도 특허가 걸려 있기 때문에, 이 특허가 끝나지 않았다면 동일한 첨가물을 포함시킬 수 없다. 그 결과, 약이 흡수되는 양이나 효력이 나타나는 시간 등이 달라지는 경우도 있다. 실제로 '제네릭 의약품'으로 바꾸고 알레르기 반응이 나타났다는 사례나, 제네릭 의약품으로 바꾸고 효력이 떨어졌다는 시례도 여럿 보고되고 있다. 물론 '제네릭 의약품' 중에는 '오리지널 의약품'과 다르지 않은 훌륭한 약도 있다.
5. 시판 후 임상 시험
또 의약품에 대해서는, 실제 환자에게 사용된 후에도 '시판 후 임상 시험'이라는 조사가 이루어진다. 이것은 의약품이 예상한 대로 효과가 나타나는지, 또 예상치 못했던 부작용은 없는지 등을 조사하는 것이다. '제4상 시험'이라고 부르기도 한다. 예컨대 1000명을 대상으로 '임상 시험'을 통해 중대한 부작용이 생기지 않았다고 해도, 10000명 당 1명의 비율로 부작용이 생기는 경우도 있다. 또 약과 약, 약과 식사의 조합으로 인해 생각지도 못한 상호 작용으로 위독한 부작용이 나타날 가능성도 있다. 물론 판매되기 전에 정밀한 조사를 하지만, 이러한 위험성을 완전히 배제할 수 있는 것은 아니다. 따라서 '시판 후 임상 시험'도 중요하다.
실제로 이 조사로 예상 밖의 부작용이 발견되어, 의약품의 판매가 중단되는 경우도 있다. 예컨대 '대상포진 바이러스' 등의 항바이러스제인 '소리부딘(Sorivudine)'은 1993년 일본에서 판매되었다. 그러나 그 후 '소리부딘'은 항암제인 '플루오로우라실'과 동시에 투여된 경우, 백혈구가 감소하는 등 중대한 부작용이 나타난 결과적으로 사망에 이른다는 사례가 다수 보고되었다. 그 보고를 받고 '소리부딘'을 판매했던 일본 상사는 소리부딘을 자진 회수했다.
6. 미래의 신약
6-1. IT 신약 개발
'약의 씨앗'을 찾는 것은 단백질에 딱 들어맞는 화합물을 찾는 일이라고 할 수 있다. 그러나 질병의 근원이 되는 단백질과 약의 후보가 되는 화합물의 조합은 헤아릴 수 없이 많다. 따라서 '고속 대량 스크리닝(HTS: High-Throughput Screening)'을 사용한다고 해도, 모든 화합물의 결합 정도를 실험으로 확인할 수는 없다. 신약 개발에 들어가는 시간과 비용도 너무 많이 들어간다.
그래서 최근에 주목받는 방법이 고성능 컴퓨터로 단백질의 분자 구조를 3차원적으로 그려내고, 그 단백질과 화합물과의 결합의 강도를 정확하게 계산함으로써 의약품이 되는 화합물을 찾는 방법이 연구되고 있다. 이러한 방법을 'IT 신약 개발' 또는 '인실리코 생물학(In Silico Biology)'이라고 한다. '인실리코(In Silico)'란 '컴퓨터를 사용해서'라는 뜻이다. 컴퓨터로 단백질을 3차원적으로 그려낸다고 해도, 말처럼 그렇게 간단하지는 않다. 단백질은 고정된 모양이 아니라, 모양을 바꾸면서 물속을 둥둥 떠다니기 때문이다. 즉, 단백질과 화합물의 강도를 정밀하게 계산하기 위해서는, 단백질의 모양 변화까지도 고려해야 한다.
그렇게 하기 위해서는 단백질의 구조뿐만 아니라, 그 주변의 물 분자와의 상호 작용도 포함한 시뮬레이션이 필요하다. 이 방법을 '분자동력학법(MD)'이라고 한다. 그러나 '분자동력학법'에는 큰 문제가 있다. 정밀하게 계산하려고 하면, 막대한 시간이 걸리는 것이다. 세계 유수의 계산 속도를 자랑하는 일본의 슈퍼컴퓨터 '케이'를 사용해도, 하나의 단백질과 하나의 화합물의 결합 강도를 계산하는 데만 며칠이 걸린다고 한다. 이 상태로는, 매우 정밀한 계산 결과라고 해도, 방대한 화합물에서 '약의 씨앗을 추려내는 작업(스크리닝)'에 사용할 수 있다.
그래서 이 문제를 해결하기 위해 새로 개발된 방법이 'CGBVS법'이라고 불리는 방법이다. CGBVS법에서는 먼저 이미 결합한다는 것을 알고 있는 단백질과 화합물의 조합을 컴퓨터에 학습시킨다. 그리고 그 결과로부터 결합의 패턴을 이끌어냄으로써, 미지의 단백질이 어떤 화합물과 결합하는지 추측한다. 이 방법을 사용하면 고속으로 판단할 수 있다. 일본 교토 대학 대학원 의학연구과의 '오쿠노 야스시' 교수는 CGBVS법의 프로그램을 '케이'를 통해 실행시켰다. 지금까지의 연구 결과로부터 결합한다는 것을 이미 알고 있는 단백질과 화합물의 조합 12만 개의 데이터를 학습시키고, 그 후 631종의 단백질과 3000만 종의 화합물의 모든 조합에 대해 각각의 조합이 어느 정도의 강도로 결합하는지를 추정토록 했다. 그 결과, 일반 컴퓨터로는 20년 걸린다고 생각되는 계산이 '케이'에서는 약 3년이 걸렸다고 한다.
6-2. 항체 의약품
'항체 의약품(Antibody Drug)'은 새로운 신약 유형의 대표격이다. '항체(Antibody)'란 외부에서 들어오는 병원체나 바이러스를 공격하는 '면역 기능'에 관여하는 단백질이다. 항체는 표적이 되는 단백질에 따라 종류가 달라, 정확하게 결합해야 할 상대를 '인식'할 수 있다. 항체가 가진 이러한 특징을 의약품으로 활용하는 것이 '항체 의약품'이다.
예컨대 암세포만이 가진 단백질을 표적으로 하는 항체를 만들어 약물로 투여하면 그 암세포에만 약물이 작용할 수 있다. 2014년 일본 '오노 약품'에서 피부 등에 발생하는 악성 흑색종에 대한 항암제 '니볼루맵(Nivolumab)'이 판매되었다. 이것은 암세포를 표적으로 하는 것이 아니라, 면역 세포인 T세포의 표면에서 생기는 'PD-1'이라는 단백질에 결합하는 항체이다. '니볼루맵'은 PD-1에 결합함으로써 T세포를 활성화시키고 암세포에 공격을 촉진한다. 니볼루맵이 직접 암세포를 공격하는 것이 아니라, 면역 반응을 활성화시킴으로써 간접적으로 암세포를 공격하는 구조이다. 따라서 정상 세포에는 악영향을 끼치지 않는다. 즉, 부작용이 적다는 장점이 있다.
6-3. iPS를 이용한 신약 개발 연구
2012년에 노벨 의학·생리학상을 수상한 일본 교토 대학의 '야마나카 신야'교수가 만든 '유도만능줄기세포(iPS 세포)'가 신약 개발의 상식을 뒤엎으려고 하고 있다. 'iPS 세포'는 '몸의 모든 세포로 변할 수 있는 능력'과 '높은 증식 능력'을 인공적인 조작으로 복구시킨 세포이다. iPS 세포를 이용한 방법에는 어떤 것이 있을까? 알츠하이머 치료약의 개발 연구를 예로 살펴보자.
지금까지는 알츠하이머병에 효과가 있는 약을 찾기 위해, 알츠하이머병과 비슷한 증상을 나타내는 생쥐를 이용해 실험을 해왔다. 왜냐하면 실제 환자로부터 뇌의 신경 세포를 빼낼 수는 없기 때문이다. 그러나 이 생쥐가 실제 환자의 증상을 그대로 재현했는지는 확인할 길이 없다. 또 생쥐에 효능이 있는 화합물이 발견되었다고 해도, 그것이 사람에게 효과가 없는 경우가 많았다.
한편, iPS 세포를 이용한 신약 개발 연구는 다음과 같이 진행된다. 먼저 알츠하이머병 환자에게서 '피부 세포'나 '혈액 세포' 등을 추출한 뒤, iPS 세포로 변화시키기 위한 유전자를 세포 안에 넣어 iPS 세포를 만든다. 이 iPS 세포에 뇌의 신경 세포로 분화하는 자극을 주면, 다양한 조직 세포로 변한다. 그러면 알츠하이머병 환자의 신경 세포와 같은 특징을 가진 신경 세포도 얻을 수 있다. iPS 세포에서 만들어진 신경 세포는 알츠하이머병 환자로부터 채취했기 때문에 질병의 특징을 나타낸다. iPS 세포는 거의 무한 증식이 가능하기 때문에 신경 세포를 대량으로 확보할 수 있다. 지금까지 결코 손에 넣을 수 없었던 환자의 '신경 세포'를 실험에 사용할 수 있게 된 셈이다. 만들어진 신경 세포를 샬레에 넣고 구획마다 다른 화합물을 더해 효과를 조사한다. 알츠하이머병의 특징을 나타내는 신경 세포에 대해 효과를 보였던 화합물이, 다른 장기의 세포에서 부작용을 나타내지는 않는지 검사한다. 이로써 신약의 후보가 추려진다.
6-4. 정밀 의료
한 사람 한 사람의 성격이 다르듯이 약효에도 개인차가 있다. 이 개인차가 생기는 비밀은 DNA에 숨어 있다. DNA 정보는 'A(아데닌)', 'T(티민)', 'G(구아닌)', 'C(시토신)'종의 염기 배열에 따라 각각 달리 기록되어 있다. 이 배열의 차이가 한 사람 한 사람의 개성을 만들어 낸다. 사람이 가지고 있는 약 30억 개나 되는 개개인의 염기 배열을 비교하면, 같은 '유전자(DNA에서 단백질의 설계 정보가 기록된 부분)'이지만 그중 염기 하나만 다른 경우가 많이 존재한다. 이 염기 하나의 차이를 '스닙스(SNPs)' 또는 '단일 염기 다형성(Single Nucleotide Polymorphism)'이라고 부른다. SNPs는 유전자로부터 만들어지는 단백질의 작용에 미묘한 영향을 끼친다. 그리고 그것이 약의 효능이나 부작용에 관여한다.
구체적으로 심근경색 등의 환자에 사용하는 약인 '와파린(Warfarin)'을 예로 알아보자. '와파린'은 약효가 나타난 후, 간에서 'CYP2C9(시프2C9)'라는 효소에 의해 분자 모양을 바꾸어 효과를 잃으며 몸 밖으로 배출된다. 그러나 일부의 사람은 CYP2C9의 유전자가 조금 다르기 때문에 CYP2C9의 기능이 약하다. 그 결과, 와파린은 분자 모양을 바꾸지 않고, 약효를 유지한 상태로 장시간 동안 몸속에 남아 있다. 이 약은 혈액이 잘 응고되지 않게 하기 때문에 출혈이 일어나면 지혈이 안된다는 부작용이 나타난다. 그래서 와파린을 투여하기 전에 미리 환자의 유전 정보를 조사하고, CYP2C9의 기능이 약한 환자에 대해서는 투여량을 줄임으로써 부작용의 위험성을 낮추려는 시도가 이루어졌다. 이처럼 개개인의 유전 정보를 조사해 이 유전 정보로부터 약의 효능, 부작용, 투여량 등을 예측하려는 시도를 '맞춤 의료(Precision Medicine)'라고 부른다.
2015년 1월 20일, 미국의 오바마 대통령은 '정밀 의료(Precision Medicine)'를 추진한다는 계획을 발표했다. 이 계획은 수백만 명의 미국인의 의료 기록과 유전 정보를 모아 대규모 데이터베이스를 만듦으로써, 질병과 그 원인이 되는 유전자를 잇는 새로운 관계를 발견하려는 시도이다. 이러한 정보를 토대로 새로운 치료 방침을 세워, 일상적인 의료 관리에 활용하는 등 폭넓은 연구가 전개될 것으로 생각된다. 지금까지와는 차원이 다른 방대한 데이터에서 새로운 의료의 패러다임이 나타날 것으로 기대된다.
6-5. 핵산 제제
지금까지는 단백질을 표적으로 하는 약을 설명했다. 그러나 '유전병(유전자에 이상이 있는 질병)'에 대한 치료를 하기 위해서는 DNA나 RNA 등의 유전자 수준에서 치료를 하는 편이 더 효과적이다. 그래서 현재 질병의 원인이 되는 유전자의 기능을 개선하는 '핵산 제제(DNA나 RNA)'를 환자의 몸속에 투여함으로써 질병을 치료하는 연구도 진행되고 있다.
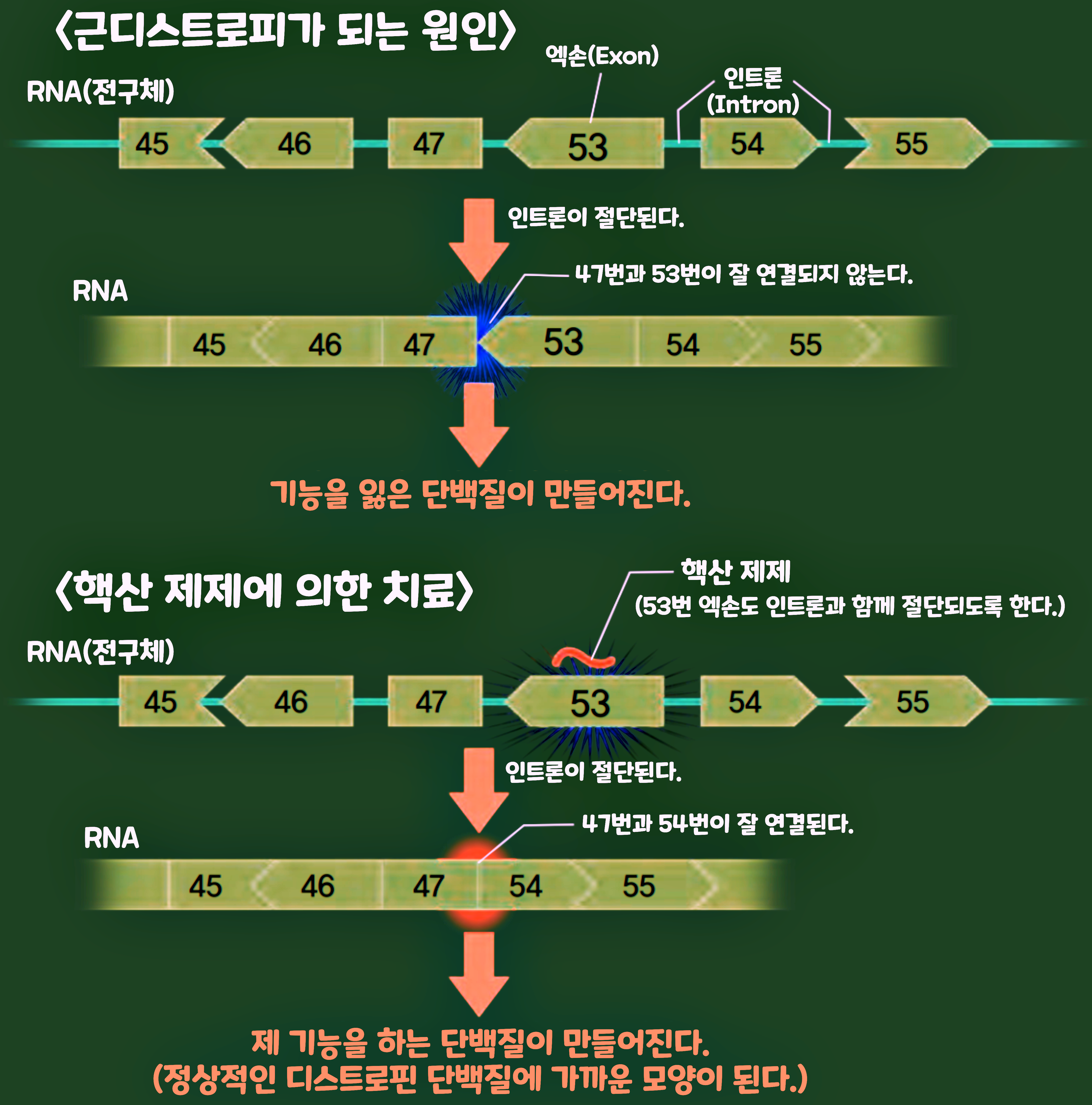
일본신약주식회사는 'NS-065/NCNP-01'이라고 불리는 '핵산 제제'의 연구 개발에 성공해, 2020년에 FDA의 승인을 받아내는 데 성공했다. NS-065/NCNP-01은 '뒤시엔느 근디스트로피(DMD: Duchenne Muscular Dystrophy)'라는 근육의 질병에 대한 것이다. DMD는 '디스프로핀(Dystrophin)'이라고 불리는 근육 세포의 근본을 만드는 단백질 유전자에 변이가 있기 때문에, 정상적인 기능을 하는 '디스트로핀 단백질'이 만들어지지 않는 것이 원인으로 발병한다. NS-065/NCNP-01은 디스트로핀 유전자의 복제품인 RNA에 달라붙음으로써, 정상적인 기능을 하는 디스트로핀 단백질을 만드는 것을 목적으로 한다.
아래는 '뒤시엔느 근디스트로피(DMD)'에 대한 핵산 제제의 모습을 그린 것이다. DNA의 유전자는 RNA로 복제되고, 이것을 토대로 단백질이 합성된다. 그리고 RNA 안의 많은 부분은 절단되어 제거된다. 제거되는 부분은 '인트론(Intro)', 제거되지 않고 남겨진 부분을 '엑손(Exon)'이라고 한다. DMD 환자가 가지고 있는 '디스트로핀 유전자'는 48번째에서 52번째까지 엑손이 빠져 있다는 특성이 있다. 47번째와 53번째의 엑손은 서로 잘 연결되지 않기 때문에, 정상적인 기능을 하는 단백질이 만들어지지 않는다. 하지만 '핵산 제제'인 NS-065/NCNP-01은 53번째의 엑손에 달라붙음으로써, 53번째의 엑손이 인트론과 함께 절단되게끔 한다. 이 작용으로 인해, 제 기능을 가진 디스트로핀 단백질이 만들어지고 치료 효과가 나타난다.
6-6. 그린 케미스트리
환자의 건강과 직결되어 있기 때문에, 의약품은 재고가 떨어지는 일이 있어서는 안 된다. 즉, 의약품은 대량 합성되어야 한다.
복잡한 의약품의 경우, 간단한 구조를 한 화합물로부터 수십 단계에 이르는 화학 반응을 거쳐 만들어진다. 지금까지 이러한 의약품의 화학 반응은 한 단계마다 다른 탱크를 사용해 이루어져 왔다. 즉, 하나의 화학 반응이 끝나면 불필요한 부산물은 제거하고 필요한 재료만을 다음 탱크로 보내는 작업을 수십 번 반복해서 만들어진 것이다. 따라서 대량의 약을 만들려면, 그만큼 거대한 장비가 필요했다. 또 불필요한 부산물 중에는 인체나 환경에 해로운 것도 있어서, 그것을 어렵다는 단점도 있었다.
2015년 4월, 일본 도쿄 대학 대학원 이학계 연구과의 '고바야시 슈(小林 修, 1959~)' 교수는 2015년 4월 화학 반응을 돕는 '촉매'를 개량함으로써 '항울제(우울증 치료제)'인 '롤리프램(Rolipram)'을 원료로부터 일관되게 연속적으로 합성하는 기술을 개발했다. 약이 되는 원료를 튜브에 넣으면, 튜브를 지나가면서 화학 반응이 일어나고, 출구로 나왔을 때는 의약품이 완성된다. 이 방법은 제조 과정에서 불필요한 부산물이 발생하지 않기 때문에, 환경친화적이라는 장점도 있다. 또 이 설비는 책상 위에 올려놓을 수 있을 정도의 소형으로 생산 비용을 크게 줄일 수 있었다. 이 방법은 촉매를 개발함으로써 '롤리프램'뿐 아니라 다른 의약품으로도 응용할 수 있다. 이처럼 환경친화적인 화학 합성 방법을 '그린 케미스트리(Green Chemistry)'라고 한다.