-
'원자(Atom)'란 무엇인가?과학(Science)/화학 (Chemistry) 2022. 4. 24. 17:23
만물은 '원자(atom)'으로 이루어져 있다. 그런데 '원자'의 정체는 무엇일까?
0. 목차
- 원자의 정체를 밝힌 주요 과학자
- 원자의 정체
- 전자는 파동과 입자의 성질을 동시에 갖는다.
- '전자구름'의 모양
- '전자의 수'가 원소의 화학적인 성질을 결정한다.
- 양성자와 중성자의 발견
- 동위 원소 (isotope)
- 핵력 (Nuclear force)
- 우주의 원소 존재도
1. 원자의 정체를 밝힌 주요 과학자
- 1785년경(앙투안 라부아지에): 원소의 개념, 질량 보존의 법칙
- 1799년(조제프 프루스트): 일정 성분비의 법칙
- 1803년(존 돌턴): 원자론
- 1804년(존 돌턴): 배수 비례의 법칙
- 1811년(아메데오 아보가드로): 분자의 개념, 아보가드로 상수
- 1869년(드미트리 멘델레예프): 주기율표(1968년에 발견 후 다음해에 발표)
- 1897년(조지프 존 톰슨): 전자의 존재 인식
- 1905년(알베르트 아인슈타인): 원자의 실재를 이론적으로 증명
- 1908년(장 페렝): 원자의 실재를 실험으로 증명
- 1911년(어니스트 러더퍼드): 원자핵의 발견
- 1911년(프레더릭 소디): 동위 원소의 발견
- 1913년(닐스 보어): 전자 궤도에 관한 가설
- 1924년(루이 드브로이): 전자의 파동설
- 1926년(에어빈 슈뢰딩거): 전자의 파동 방정식
- 1932년(제임스 채드윅): 중성자의 발견
반응형2. 원자의 정체
2-1. 원자의 크기
원자의 평균적인 크기는 1000만 분의 1mm 정도라고 한다. 야구공과 원자 1개의 크기를 비교하는 것은, 지구와 유리구슬 1개의 크기를 비교하는 것과 같다. 이렇게 작으니 눈으로 직접 볼 수는 없다. 특별한 현미경은 대략적인 모양은 알 수 있으나, 자세한 구조까지는 보이지 않는다. 그러나 근대 과학자들의 탐구에 의해 그 모습이 점차 밝혀져왔다.
원자는 서로 다른 모양을 한 구름 같은 것이 겹쳐 커다란 공을 이루고 있다. 구름처럼 보이는 것의 정체는 '전자(electron)'이고, 중앙에는 '원자핵(Atomic Nucleus)'이 있다. 원자의 질량은 거의 모두가 이 원자핵에 집중되어 있다. 그러나 원자핵의 반지름은 원자 전체의 1만 분의 1 정도이며, 실제로는 점으로도 그릴 수 없을 정도로 작다. '원자(Atom)'은 원자핵과 그것으로 둘러싼 '전자구름(electron cloud)'으로 이루어진다.
2-2. 전자의 발견
19세기 말, 과학자들은 '원자야말로 물질의 최소 단위이며, 더 이상 분할할 수 없는 입자'라는 생각을 하게 되었다. 하지만 1897년에 원자의 '부품'에 해당하는 '전자(electron)'가 발견되면서, 원자가 더욱 분할된다는 사실이 밝혀졌다. 전자를 발견한 사람은 영국의 물리학자 '조지프 좀 톤슨(Joseph John Thomson, 1856~1940)'으로, 그는 '음극선(Cathode ray)'의 연구에서 전자를 발견했다. 공기를 제거해 거의 진공으로 만든 유리관의 양 끝에 전압을 걸면, 내부에서 보라색의 빛이 나온다. 이것을 '진공 방전(vacuum discharge)'이라고 한다. '번개(lightning)'는 자연에서 일어나는 '방전(discaharge)이며, '진공 방전'이 번개와 같은 원인으로 일어난다는 사실은 당시에도 알려져 있었다.
진공 방전이 일어나는 유리관에서 공기를 더 빼면 보라색의 빛은 사라지고, '양극(+)'쪽의 유리관이 형광을 내게 된다. 이것은 '음극(-)'에서 방출된 '무언가'가 '양극(+)' 쪽의 유리에 부딪쳐, 그 결과 유리가 빛나는 것으로 생각되었다. 그리고 이 '무언가'가 바로 '음극선(Cathode ray)'이다.
'음극선(Cathode ray)'의 정체를 밝힌 사람이 바로 '조지프 좀 톰슨'이다. '조지프 좀 톰슨'은 '음극선'이 '수소 원자의 약 2000분의 1'이라는 '극히 가벼운 질량을 가진 음전기를 띤 입자의 흐름'이라는 사실을 밝혀냈다. 이 입자가 '전자(electron)'이다. '진공 방전'이나 '번개'는 '전자'가 일으킨 것이었다. 나아가 톰슨은 '전자가 언제나 같은 질량이라는 점'과 '어떤 원자에서 나오는 음극선이라도 같은 입자라는 점'을 실험을 통해 밝혀냈다. 그래서 '전자는 원자의 일부'라고 생각하게 되었다.
2-3. '원자의 구조'를 생각하기 시작했다.
전자가 발견되고 나서, 원자의 구조'에 대한 많은 억측들이 난무했다. 전자가 발견되고 나서, 과학자들은 다양한 원자의 구조에 대해 여러 가지 모델을 생각하기 시작한 것이다. 톰슨도 원자의 구조를 생각해 보았는데, 그가 생각한 구조는 양전기를 띤 커다란 공 안에서 작은 전자가 원 궤도를 그리면서 움직이는 것이었다.
- 건포도 빵 모델: '건포도 빵 모델'은 양전기를 띤 공의 내부에 많은 전자가 파고들어 자유롭게 회전하는 모델이다. 영국의 물리학자 '켈빈 경(본명은 윌리엄 톰슨, 1824~1907)'이 주장한 모델이다. '전자를 발견한 '조지프 좀 톰슨'도 처음에는 이와 같은 모델은 생각했다고 한다.
- '조지프 좀 톰슨'의 원자 모델: '조지프 좀 톰슨'은 전자가 정해진 궤도를 움직인다고 생각했다. 나아가 궤도는 하나만이 아니라, 여러 개 있는 쪽이 원자 전체적으로 안정된다고 생각했다. 톰슨은 기체의 전기 전도 연구로 1906년에 노벨 물리학상을 받았다.
2-4. 원자의 한가운데에 '양전기의 덩어리'가 있었다.
보통의 기체나 액체는 그 자체로써 전기를 띠고 있지는 않다. 즉, '원자(atom)'는 원래 전기적으로 중성이라고 생각된다. 하지만 원자의 일부인 전자는 '음전기(negative electricity)'를 띠고 있었다. 그러면 '음전기'를 없애는 '양전기'가 어디엔가 어디에 있어야만 한다. 그러면 '양전기'는 과여 어디에 있을까?
이에 대한 답을 내놓은 사람이 영국의 물리학자 '어니스트 러더퍼드(Ernest Rutherford, 1871~1937)'이었다. 당시는 X선 등의 '방사선(Radioactive ray)'이 발견된 시대로, 방사선은 최첨단의 연구 테마였다. 러더퍼드는 '알파선(Alpha ray)'이라는 강한 방사선을 연구하다가 '알파선'의 정체가 '전자보다 약 8000배나 무거운 양전기를 띤 입자'라는 사실을 밝혀냈다.
'알파 입자(정체는 헬륨의 원자핵)'는 매우 빨리 날아가는 무거운 입자이다. 그래서 러더퍼드는 이 입자를 원자로 향하게 해도 그대로 지나가거나, 전자의 영향을 받아 약간 진로가 바뀔 것이라고 생각했다. 하지만 1909년 연구실의 젊은 연구원 '한스 가이거(Hans Geiger, 1882~1945)'와 '어니스트 마스든(Ernest Marsden, 1889~1970)'에게 그 측정을 시켰더니, 전혀 뜻밖의 결과가 나왔다. 약 10000회에 아주 드문 확률로, '큰 각도로 휘어지는 알파 입자'가 확인된 것이다. 심지어 가끔은 진행 방향과 반대 방향으로 도로 튀어나오는 것도 있었다. 8000분의 1의 질량밖에 안되는 전자가 훨씬 무거운 알파 입자를 튀어난다고 생각할 수는 없었다.
그래서 러더퍼드는 실험 결과를 바탕으로 '원자 한가운데의 좁은 영역에 양전기가 집중해 있으면, 강한 전기력이 생겨 알파 입자가 튀어나온다.'고 생각하였다. 즉, 양전기가 원자 한가운데의 아주 좁은 영역에 집중에 있다고 생각한 것이다. 그리고 그 결과를 1911년에 발표하였다. 양전기의 공이 그만큼 작다고 생각하지 않았던, 이전의 원자 모델에서는 이 실험 결과를 설명할 수 없었다.
2-5. 보어가 생각한 새로운 원자 모델
러더퍼드의 실험 결과가 발표된 뒤, 과학자들은 원자의 진짜 모습을 알아내기 위해 연구를 계속했다. 이와 같은 연구의 선두에 있었던 사람이 덴마크의 이론 물리학자 '닐스 보어(Niels Bohr, 1885~1962)'였다. 우선 '닐스 보어'는 우선 '러더퍼드'의 실험 결과를 만족시키는 '원자 모델(atom model)'을 생각했다. 그것은 원자의 한가운데에 있는 양전기 덩어리를 둘러싸는 식으로 전자가 자유롭게 움직이면서 회전한다는 것이다. 그리고 보어는 이 양전기의 덩어리에 '원자핵(Atomic Nucleus)'이라는 이름을 붙였다.
이 원자 모델은 '태양계(Solar system)'와 비슷해 보인다. 태양계에서는 행성들이 중심에 있는 태양 주위를 돌고 있기 때문이다. 하지만 '전자(Electron)'와 '행성(Planet)'이 비슷하다고 생각하면, 문제가 생겼다. '전자기학(Electromagnetism)'에 따르면, '전기를 띤 것(전자)'이 움직여 회전한 경우, 빛을 내면서 에너지를 읽게 된다. 그래서 만약 '전자(Electron)'가 움직여 회전하고 있다면, 에너지를 잃고 약 1억 분의 1초 만에 원자핵과 충돌해 버릴 것이라고 생각되었다. 그러면 원자 안에서 전자는 어떻게 존재하고 있을까? 보어는 이 문제를 해결하기 위해 고민했고, 이를 설명할 수 있는 '새로운 가설'을 1913년에 발표하였다. 그는 원자의 모습을 설명하기 위해 전자기학을 부정하고, 다음과 같은 규정을 새로 만들었다.
- 원자핵의 주위에는 다양한 형태나 반지름의 궤도가 존재할 수 있다.
- 그러나 전자는 어떠한 궤도라도 취할 수 있는 것은 아니다.
- 전자에게 허가된 것은 많은 것 중에서 어느 한정된 궤도뿐이다.' 전자는 원자핵에 가장 가까운 궤도보다 더 안쪽에 들어갈 수는 없다.
이 규정에서는 전자가 원자핵에 가장 가까운 궤도보다 더 안쪽에 들어갈 수가 없다. 따라서 전자와 원자핵이 충돌하는 경우는 일어나지 않는다. 억지스러운 규정처럼 보일지 모르겠지만, 보어는 그때까지의 물리학과는 다른 물리학을 새로 생각해 냈다. 그 후 보어는 다른 연구자들과 더불어 이 생각을 발전시켰고, 여러 전자 궤도를 포함하는 그룹이 여러 개 존재한다고 생각하게 되었다. 그리고 그 그룹을 '전자 껍질(electron shell)'이라고 불렀다.
반응형3. 전자는 파동과 입자의 성질을 동시에 갖는다.
1897년에 '조지프 좀 톰슨(Joseph John Thomson, 1856~1940)'이 전자를 발견한 이래, 사람들은 전자를 입자로 생각하고 있었다. 1913년에 새로운 원자 모델을 생각해낸 '닐스 보어'도 당시에는 전자가 입자라고 생각했다. 하지만 1920년대에 들어와 이러한 견해는 완전히 뒤집히고 말았다. 보어도 견해를 바꾸지 않을 수 없었다. 그러면 원자의 정체는 도대체 무엇일까? 이에 원자의 모습을 두고 당시 물리학자들 사이에서 많은 논의가 이루어졌다.
그 결과 나온 것이 '양자 역학(Quantum Mechanics)'이라는 아주 작은 세계를 설명하기 위한 학문이었다. 오스트리아의 이론 물리학자 '에르빈 슈뢰딩거(Erwin Schrodinger, 1887~1961)'나 영국의 물리학자 '막스 보른(Max Born, 1882~1970)' 등에 의하면, 전자는 '입자와 파동의 성질을 동시에 가진 입자'였다. 원자핵 주위에 존재하는 전자는 위치와 운동의 모습을 특정할 수 없지만, '전자가 존재할 수 있는 영역은 알 수 있을 것 같다. 1개의 전자는 그 영역 안에서 무수한 장소에 동시해 무수히 존재하고 있으리라 생각되는 것이다. 상식으로는 이해하기 어려운 견해라고 느껴질 수도 있겠지만, 이렇게 생각함으로써 다양한 실험 결과를 설명할 수 있었다.
전자의 위치와 운동 모습은 특정할 수 없다. 그래서 전자를 나타내기 위해 전자가 존재하는 영역을 '구름(cloud)'처럼 그리는 것이 일반적이다. 전자가 존재할 확률이 높은 영역의 구름은 짙게 그리고, 전자가 존재할 확률이 낮은 영역의 구름은 옅게 그리는 것이다. 그림을 보면 '무수히 많은 전자'가 존재하는 것처럼 보이지만 실은 그렇지 않으며, 마치 분신술처럼 '하나의 전자'가 무수한 장소에 동시에 존재하는 모습을 그린 것이다.

전자 구름(electron cloud) 3-1. 양자역학에 기여한 과학자들
- 닐스 보어: 1913년에 '보어의 가설'을 발표하였다. 그후 양자 역학에서 지도적인 입장에 있었다. 1922년에 노벨 물리학상을 받았다.
- 루이 드브로이: 1924년에 '물질파'를 제창하였다. 전자는 파동의 성질을 가진다고 주장하였다. 1924년에 노벨 물리학상을 받았다.
- 에어빈 슈뢰딩거: 1926년에 '파동 방정식'을 제창하였다. 이에 따라 파동의 성질을 가진 '전자'의 움직임을 설명할 수 있게 되었다. 1933년에 노벨 물리학상을 받았다.
- 볼프강 파울리: 1924년에 전자의 상태를 나타내는 '배타 원리'를 제창하였다. 1945년에 노벨 물리학상을 받았다.
- 막스 보른: 1926년에 '확률 해석'을 제창하였다. 이에 따라 전자를 구름처럼 그리게 되었다. 1954년에 노벨 물리학상을 받았다.
반응형4. '전자구름'의 모양
4-1. '전자구름'과 '전자의 정원'
'전자 껍질'의 모양은 일정한 규칙에 의해 정해진다. 우선 K껍질, L껍질, M껍질... 의 전자 껍질이 있으며, '전자 껍질'은 또 '전자 부껍질' 들로 구성되어 있다. 예컨대, 'K껍질'은 1s 전자 부껍질로 이루어져 있고, 'L껍질'은 2s, 2p의 전자 부껍질로 이루어져 있고, 'M껍질'은 3s, 3p, 3d의 전자 부껍질로 이루어지는 식으로 되어 있다. 전자 부껍질은 전자의 정원이 정해져 있다. 그리고 아래의 표에서 s, p, d, f...은 전자의 모양이고 2, 6, 10 14... 등은 그 '전자 부껍질'에 들어갈 수 있는 '전자의 정원'이다.
원자핵에서 먼 전자껍질일수록 많은 전자 부껍질을 갖기 때문에 전자껍질에 존재할 수 있는 전자의 총수도 많아진다. 그리고 전자 부껍질은 각각 원자핵까지의 '가까운 정도'가 서로 다르다. '아래의 표'에서 보라색 화살표는 '원자핵에서 가까운 전자 부껍질의 순서'를 나타낸 것이다. 원자핵으로부터 가장 가까운 '전자 부껍질'을 순서대로 배열하면, 아래에 있는 그림처럼 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p 7s, 5f, 6d, 7p... 와 같은 순서이다. 예컨대, M 껍질에 있는 4s 전자 부껍질은, M 껍질에 있는 3d 전자 부껍질보다 원자핵에 가깝다.
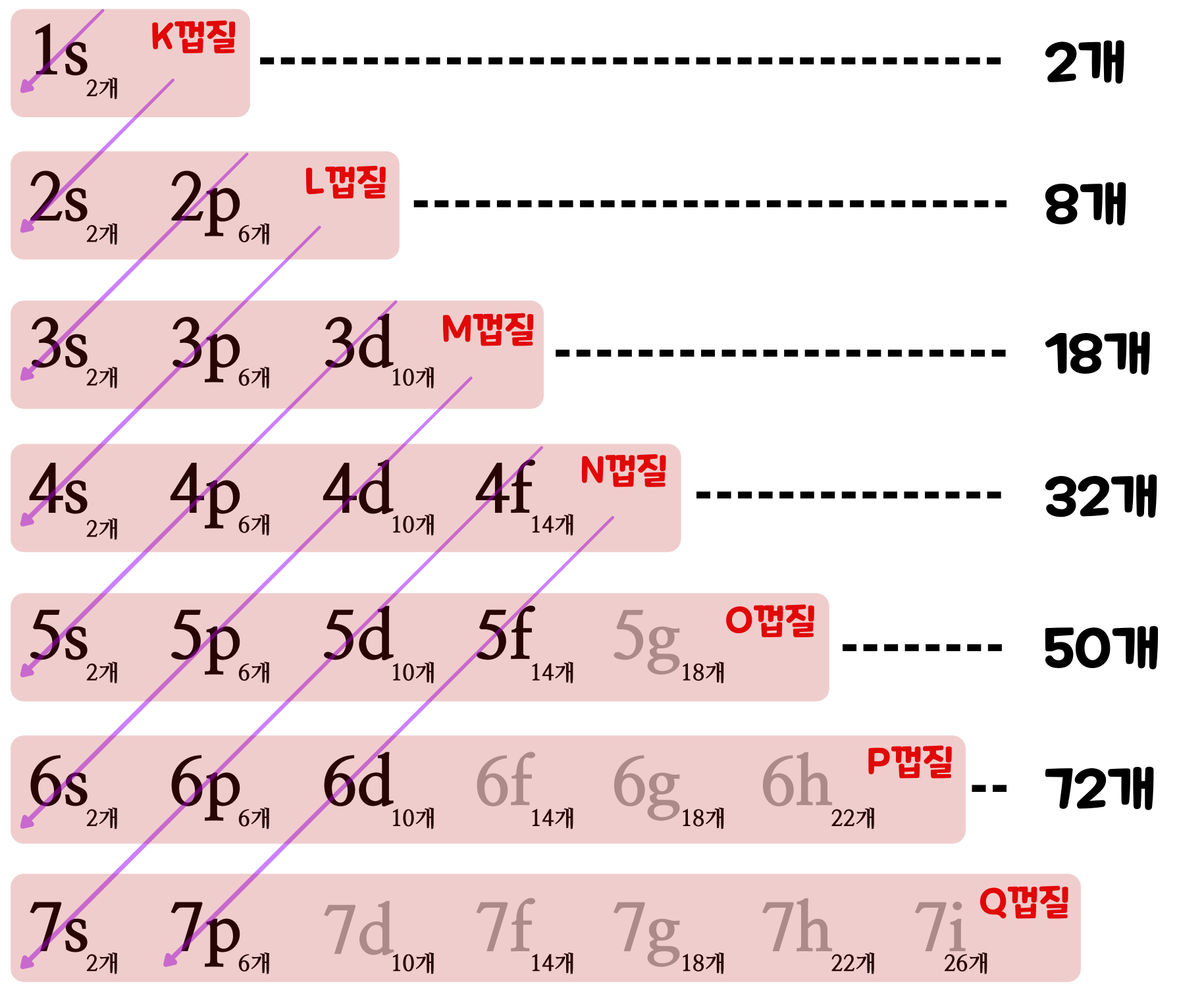
4-2. 전자의 정원은 어떻게 정해질까?
그러면 각 '전자 부껍질'의 '전자의 정원'은 어떻게 정해지는 걸까? 예컨대 3d 전자 부껍질은 왜 10개의 전자 정원을 가지고 있고, 4f 전자 부껍질은 왜 14개의 전자 정원을 가지고 있을까?
1924년 스위스의 이론 물리학자 '볼프강 파울리(Wolfgang Pauli, 1900~1958)'는 어느 하나의 '존재할 수 있는 영역'을 가질 수 있는 전자는 최대 2개라고 주장했다. 즉, 같은 모양의 '전자구름'에 전자가 최대 2개까지 존재할 수 있다는 것이다. 이를 이해하기 위해 아래의 표를 보자. 아래의 표는 K껍질~N껍질의 전자구름의 일람표이다. '전자 부껍질'의 부품에 해당하는 '전자구름'의 수는 예컨대, s는 1개 p는 3개, d는 5개, f는 7개라는 식으로 증가한다.
그러면 전자구름의 수는 왜 이런 식으로 증가할까? 전자구름의 방향이 여러 개 있다는 것은 '같은 모양의 전자구름이 여러 방향으로 존재한다는 것이다. 예컨대 2p의 전자구름의 수가 3개인 이유는, '3방향의 전자구름(상하·좌우·전후)'이 있기 때문이다. 또 3d의 전자구름이 5개인 이유는, '2방향의 전자구름' 2개와 '다른 방향이 없는 전자구름'이 1개 있기 때문이다. 또 4f의 전자구름이 7개인 이유는 '2방향의 전자구름' 3개와 '다른 방향이 없는 전자구름'이 1개 있기 때문이다. 4f '전자 부껍질'의 전자구름이 7개이고, 전자구름에 최대 2개의 전자가 존재할 수 있으므로, 4f의 전자 정원은 14개가 되는 것이다.
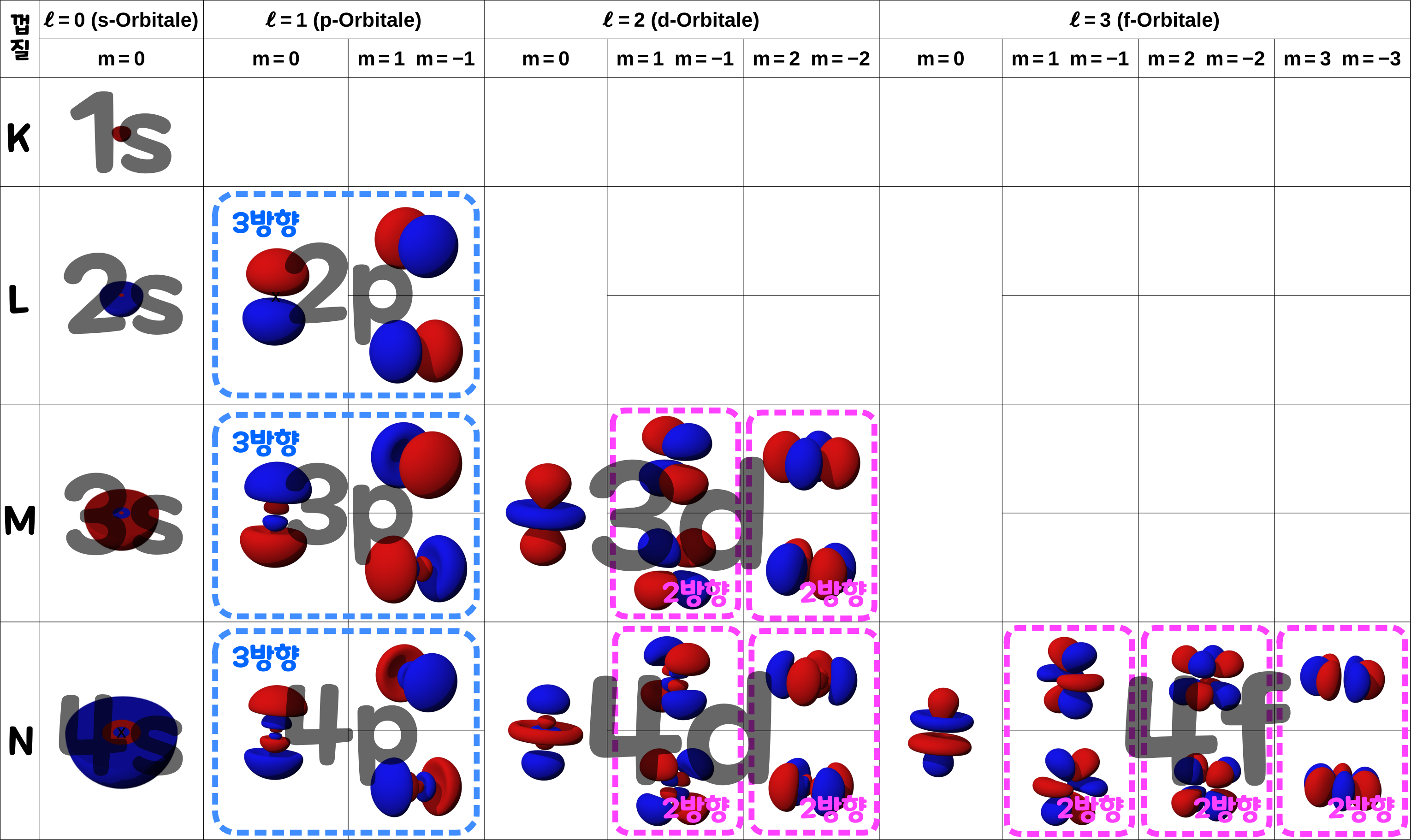
전자 구름의 모양 4-3. 전자구름이 겹쳐져서, 전체로는 하나의 공 모양의 구름처럼 보인다.
그리고 이러한 '전자구름'이 모이면 같은 장소에 겹쳐지므로, 전체를 보면 커다란 하나의 공 모양의 구름처럼 보인다. 예컨대, 우라늄(U, 원자번호 92번)'의 경우 전자구름이 49개나 겹쳐지므로, 전체를 보면 더욱 공 모양처럼 보인다.
5. '전자의 수'가 원소의 화학적인 성질을 결정한다.
원소는 각각 서로 다른 화학적인 성질을 가지고 한다. 예컨대 '수소(H, 원자번호 1번)'와 '헬륨(He, 원자번호 2번)'은 원자번호가 1밖에 차이 나지 않지만, 화학적인 성질은 크게 다르다. 헬륨은 수소처럼 폭발하지도 않고 타지도 않기 때문에 안전하므로, 풍선이나 기구를 뜨게 하는 가스로 사용된다. 그러면 이러한 화학적인 성질은 무엇으로 정해질까? 화학적인 성질을 결정하는 것은 바로 '전자의 수'이다. 특히 '가장 바깥쪽 전자껍질'에 있는 '전자의 수'가 크게 영향을 미친다. 주기율표는 가장 바깥쪽 전자껍질에 있는 전자의 수가 같은 원소들을 세로줄에 오도록 배열한 것이다. 가장 바깥쪽 전자껍질에 있는 전자의 수가 변하면, 화학 반응을 할 수 있는 상대도 바뀐다.
화합물을 조사함으로써, 원자끼리는 전자를 주고받거나 공유하여 결합하고 있다는 사실이 밝혀졌다. 즉, '화학 반응(Chemical Reaction)'은 전자가 담당하는 반응이라고 생각된다. '화학 반응'은 '전자구름(Electron Cloud)'이 담당한다. 원자끼리 전자구름을 서로 끌어당겨 하나의 커다란 구름을 형성하는 것이다. 이들이 서로 떨어지지 않는 이유는 일체가 된 전자구름의 중간에 '전자(-)'가 많이 모여, '원자핵(+)'끼리 연결시키는 '끈끈한 풀'의 역할을 하기 때문이다. 예컨대 2개의 '수소 원자(H)'가 '수소 분자(H2)'가 되는 과정을 생각해 보자. 2개의 수소 원자는 가장 바깥쪽 전자껍질의 전자 정원을 채우기 위해 서로 끌어당겨 전자를 공유한다. 그리고 전자구름이 일체가 되면서, 원자핵과 원자핵 사이에 전자가 많이 모인다. 그리고 결국 원래의 수소 원자의 전자구름과는 다른, 커다란 전자구름이 생긴다.
반응형6. 양성자와 중성자의 발견
'어니스트 러더퍼드(Ernest Rutherford)'에 의해 원자핵이 발견된 이래, 원자핵에 대해 알려진 것은 양전기의 덩어리라는 것뿐이었다. 그러나 원자에 알파 입자를 충돌시키는 연구를 계속하던 러더퍼드는 1917년에 다시 중대한 발견을 했다. '질소 원자(N, 원자번호 7번)'에 알파 입자를 충돌시키자, 그 원자핵에서 미지의 입자가 튀어나온 것이다.
이 입자는 전자 1개분의 양전기를 띠고 있었다. 그래서 러더퍼드는 이 입자를 '양성자(Proton)'이라고 명명하고, 원자핵은 양성자의 덩어리라고 생각했다. 원자가 중성인 것은 양성자 수와 전자의 수가 일치하기 때문이다. 양성자의 수를 '원자 번호'라고 한다. 하지만 이것에는 모순되는 점도 있었다. 예컨대 헬륨의 무게가 수소의 4배이며, 원자핵의 전하 크기는 수소의 2배이다. 원자핵을 구성하는 양성자의 수가 4개라면 전하가 너무 많고, 2개라면 원자의 무게를 설명할 수 없다.
이 모순을 해결한 사람이 영국의 물리학자 '제임스 채드윅(James Chadwick, 1891~1974)'이다. 채드윅이 주목한 것은 1930년에 발견된, 정체불명의 '전기적으로 중성인 입자'였다. 이 입자는 '베릴륨(Be, 원자번호 4번)'의 박막과 '파라핀(양초의 재료)'에 '알파입자(정체는 헬륨의 원자핵)'를 충돌시키는 실험에서 발견되었다. 실험 결과에서는 알파 입자가 헬륨의 박막에서 '전기적으로 중성인 입자'를 때려 나가게 한다고 추측되었다.
채드윅은 입자 속도 등을 계산해, 이 입자가 양성자와 거의 같은 질량이라는 사실을 규명했다. 그리고 이것을 '중성자(Neutron)'라고 명명했다. 이로써 채드윅에 의해, 원자핵은 양성자와 중성자로 이루어져 있음이 알려졌다. 이들 두 입자를 통틀어 '핵자(Nucleon)'라고 한다. 수소의 원자핵은 양성자 1개, 헬륨의 원자핵은 양성자 2개와 중성자 2개로 이루어져 있다. 따라서 헬륨의 무게가 수소의 약 4배라는 점도 설명할 수 있게 되었다.
반응형7. 동위 원소 (isotope)
7-1. 동위 원소의 발견
채드윅에 의해 원자핵은 '양성자(Proton)'와 '중성자(Neutron)'로 이루어져 있음이 알려졌다. 양성자의 수에 따라 '원자의 종류(원소)'가 정해지고, 중성자의 수는 원자의 무게에 영향을 미친다. 양성자와 중성자의 수의 합계를 '질량수(Mass number)'라고 하면, 그 원자의 대략적인 무게를 나타낸다.
양성자의 수는 원소마다 다르지만, 중성자의 수는 반드시 그렇다고 할 수는 없다. 예컨대 수소의 경우, 양성자는 1개로 정해져 있지만 중성자는 0개, 1개, 2개인 것이 있다. 같은 수소라도 '가벼운 수소'와 '무거운 수소'가 있는 것이다. 이처럼 '원자 번호가 같고(양성자의 수가 같고)' 중성자의 수가 서로 다른 것이 모든 원소에서 발견되었다. 양성자의 수는 같지만 중성자의 수가 다른 원소를 '동위 원소(isotope)'라고 한다.
- 수소(1H): '양성자 1개'로 이루어진 수소 원자이다. '수소1'이라고도 한다. 자연에 존재하는 수소 원자의 99.9% 이상을 차지한다.
- 중수소(2H): '양성자 1개'와 '중성자 1개'로 이루어진 수소 원자이다. '수소2'라고도 한다. 자연에 존재하는 수소 전체의 약 0.01%를 차지한다.
- 삼중 수소(3H): '양성자 1개'와 '중성자 2개'로 이루어진 수소 원자이다. '수소3'이라고도 한다. 삼중 수소는 '수소 3' 또는 '트리튬(tritium)'이라고한다. 베타선이라는 방사성 동위 원소로, 베타선이라는 방사선을 내고 헬륨 3로 바뀐다. 이에 따라 중성자 하나가 양성자로 변하고, 원자 번호가 늘어나 수소에서 헬륨이 된다.
- 인공적으로는 중성자의 수가 7개인 '칠중수소(7H)'까지 합성할 수 있음이 확인되었지만, 곧바로 붕괴한다.

수소의 '동위 원소(isotope)' 7-2. 방사성 동위 원소
'동위 원소'를 발견한 사람은 영국의 물리학자 '프레더릭 소디(Frederick Soddy, 1877~1956)'이다. 소디는 1910년경, 화학적인 성질이 같은데도, 방출하는 방사선의 특징에 차이가 나는 원자 그룹이 있다는 사실을 알아차렸다. 실제로 동위 원소 중에는 방사선을 내는 것들이 있다. 예컨대 '중성자의 수가 2개인 수소 원자'는 베타선이라는 방사선을 냄으로써 중성자 1개가 양성자로 변해서, '다른 원자핵(헬륨 3)'이 된다. 이와 같은 동위 원소를 방사성 동위 원소라고 한다.

방사성 원자핵의 베타붕괴 7-3. 원자량 (Atomic Weight)
더욱이 동위 원소는 '원자량'에도 영향을 끼친다. '원자량(Atomic Weight)'이란 질량수 12인 탄소의 무게를 12라고 했을 때, 각 원자의 상대적인 무게이다. 동위 원소가 있는 원소의 경우, 동위 원소의 존재 비율을 바탕으로 계산된다. 예컨대 탄소에는 질량수 13인 동위 원소가 1.1%의 비율로 존재한다. 그래서 탄소의 원자량은 12에 아주 가깝지만 12.0107이 된다. 또 산소의 경우는 질량수가 16(99.8%), 17(0.04%), 18(0.2%)인 것이 존재해, 원자량은 15.9994가 된다. 또 동위 원소가 없는 원소라도 원자량은 정수인 것은 아니다.
7-3-1. 왜 '탄소(C)'가 원자량의 기준이 됐을까?
그러면 왜 '탄소(C)'가 원자량의 기준이 됐을까? 원자 1개의 무게는 대단히 적은 양이다. 예컨대 수소는 0.00······00167g, 소수점 아래 0이 23개나 이어지는 수치이다. 이처럼 g 단위로 표시된 '절대 질량'을 사용하는 것은 불편하다. 그래서 특정한 원자를 기준으로, 다른 원자가 그 원자의 몇 배인가를 생각하게 되었다. 이것이 '상대 질량'이다.
애초에 1985년에는 이 기준 원소로 가장 가벼운 '수소(H)'를 사용할 것이 제창되었다. 그 뒤 1820년 무렵에는, 당시에는 원자량을 원소가 화합할 때의 질량비를 측정해 구하고 있었기 때문에, 많은 원소와 결합하는 산소를 기준 100으로 삼도록 바뀌었다. 그러나 더욱 많은 원소의 존재가 밝혀짐에 따라 1000 이상의 원자량이 나오게 되었다. 그래서 수소가 1에 가까워지는, 산소를 16으로 하는 기준이 1898년에 국제적으로 결정되었다.
1890년대에 들어와 산소에는 세 동위 원소 16O, 17O, 18O가 존재함을 알게 되었다. 원자핵의 중성자 수가 다른 원자들을 '동위 원소'라고 한다. 원소 기호의 왼쪽 어깨 위에 있는 숫자는 양성자의 수와 중성자의 수를 합인 '질량수'이다. 화학의 세계에서는 예전대로 세 동위 원소가 뒤섞인 원소의 수치를 16으로 써왔다. 하지만 물리의 세계에서는 동위 원소의 질량을 엄밀하게 비교하기 위해 16O을 16으로 하였다.
1960년에 화학회와 물리학회는 그때까지 사용되던 두 기준치에 가까워지는 새로운 기준을 검토했다. 물리의 세계에서 사용하던 16O를 기준으로 하면, 화학의 세계에서 사용하던 기준 수치와 0.027%나 달라지기 때문이었다. 그래서 탄소가 기준으로 선택되었다. 12C를 기준으로 하면 0.0043%밖에 오차가 나지 않아, 유효 숫자 4자리까지의 계산은 예전 기준으로 구한 것을 사용할 수 있다. 탄소의 동위 원소가 적다는 것도 선택 이유의 하나였다고 한다.
반응형8. 핵력 (Nuclear force)
채드윅이 중성자를 발견하고 2년 후인 1934년에, 일본의 물리학자 '유카와 히데키(ゆかわひでき, 1907~1981)'는 원자핵이 뿔뿔이 흩어지지 않도록 결합하는 힘을 예언했다. 핵자 사이를 접착시키는 특별한 풀과 같은 이 힘을 '핵력(Nuclear force)'이라고 한다. 양성자와 중성자, 양성자끼리, 중성자끼리 사이에서 발생한다. 특히, 양성자와 중성자 사이에 작용하는 강한 인력이 원자핵을 하나로 통합하고 있다고 한다.
8-1. '핵력'과 '전기적인 힘'은 무엇이 다른가?
핵력과 전기적인 힘은 주로 두 가지 점에서 크게 다르다.
- 첫째는 힘이 미치는 범위이다. 전기적인 힘은 서서히 약해지긴 하지만, 원리적으로는 무한한 거리까지 힘이 미친다고 한다. 힘이 약해지는 것은 거리의 제곱에 반비례한다. 한편, 핵력은 10-12mm의 몇 배 범위에서만 힘이 미친다고 한다. 이것은 양성자나 중성자의 반지름의 몇 배 정도이므로, 핵력은 핵자에게만 작용한다고 생각된다.
- 둘째는 힘의 세기이다. 핵력이 작용하는 범위 안에서 핵력과 전기적인 힘의 크기를 비교해 보면, 핵력이 전기적인 힘보다 약 100배 강하다는 사실이 밝혀져 있다. '양성자 사이에 전기적인 반발력'이 있지만 '핵력에 의한 인력'이 훨씬 강해서, 원자핵이 뿔뿔이 흩어지지 않는다.
반응형9. 우주의 원소 존재도
우주에는 아래의 그래프에 그려진 것과 같은 비율로 원소가 존재한다. 지구에 존재하는 원소를 비롯해, 지구에 떨어진 운석에 포함된 원소, 태양이나 그 밖의 항성에 존재하는 원소의 종류와 존재도를 정리한 것이다. 태양이나 항성에서의 원소 존재도는, 주로 독일의 물리학자 '구스타프 키르히호프(Gustav Kirchhoff, 1824~1887)'나 독일의 화학자 '로베르트 분젠(Robert Wilhelm von Bunsen, 1811~1899)'이 확립한 '분광학(Spectroscopy)'에 의해 19세기 이후 밝혀져 왔다. 그리고 최근에는 지상 망원경에 의해 다양한 천체에서 원소의 존재도가 관측된다.
이 그래프에서 주로 다음과 같은 두 가지 특징을 알 수 있다.
- 첫째는 수수와 헬륨이 아주 많고, 원자 번호가 증가함에 따라 존재도가 낮아진다는 점이다. 수소와 헬륨을 합쳐 우주 전체에서 차지하는 비율은 무려 98%나 된다.
- 둘째는 존재도가 지그재그로 되어 있다는 점이다. 양성자의 수가 짝수인 것은 서로 이웃한 홀수인 원소보다 많이 존재한다. 이것은 양성자가 2개로 짝이 되어 있는 쪽이 안정적이므로, 채워지지 않은 핵자가 있으면 변하기 쉽기 때문이다. 우주에 존재하는 원소의 양에는 양성자의 성질이 영향을 미치고 있는 것이다.

우주의 원소 존재도