-
'물'의 성질과학(Science)/화학 (Chemistry) 2022. 4. 12. 07:53
'물(Water)'은 인간과 뗄 수 없는 매우 중요한 물질인 동시에, 매우 이상한 물질이다. 고체인 '얼음'이 액체인 '물' 위에 뜨거나, 녹는점과 끓는점이 아주 높은 등 이상한 점이 대단히 많다. 물은 왜 이렇게 다른 물질에 비해 특이한 성질을 가지고 있는 것일까?
0. 목차
- 물 분자의 궤도
- 물 분자의 구조
- 수소 결합(Hydrogen Bond)
- 물의 성질
- '수소 결합'을 하는 다양한 물질들

물(Water) 1. 물 분자의 궤도
1-1. 수소와 산소를 섞어 불태우면 물이 생긴다.
기체인 '수소(H2)'와 기체인 '산소(O2)'를 섞어서 불태우면 '물(H2O)'이 생긴다. 이 반응이 일어나는 과정은 다음과 같다.
'수소'와 '산소'에서 '물'이 생기는 것이 간단한 반응처럼 보일지 몰라도, 실제의 진행과정은 복잡하다. 기체에 열을 가하면 에너지를 흡수한 '수소 분자(H2)'가 하나라도 불안정해져서 '수소 원자(H)'로 나뉘면, 그게 방아쇠가 되어 반응이 급속하게 퍼진다. '수소 분자(H)'에 '산소 분자(O2)'가 충돌하면, '산소 원자(O)'와 '히드록시기(OH)'가 된다. 그 다음 '산소 원자(O)'에 '수소 분자(H2)'가 충돌하면 '물 분자(H2O)'가 되고, '히드록시기(OH)'에 '수소 분자(H2)'가 충돌해면 '물 분자(H2O)'와 '수소 원자(H)'가 생긴다.
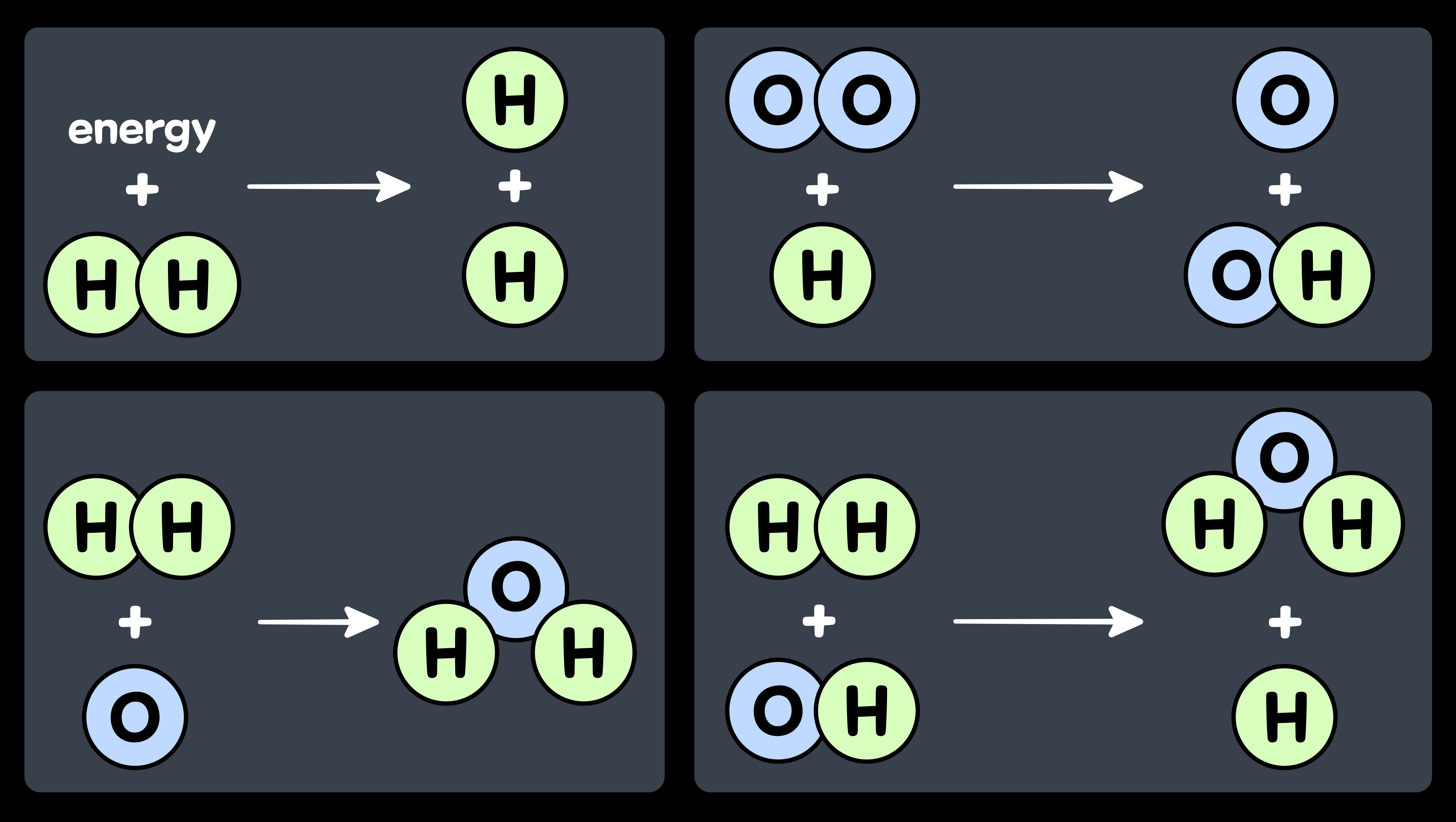
물의 합성 반응 1-2. 수소 원자와 산소 원자의 '전자 궤도'
수소와 산소의 반응으로 물이 생기는 이유는 '수소 원자 2개'와 '산소 원자 1개'가 결합하면 안정되기 때문이다. 이들이 왜 안정되는지를 이해하기 위해, '수소 원자'와 '산소 원자'의 전자 궤도에 대해 알아보자.
'수소 원자(H, 원자번호 1번)'는 'K 껍질'이라는 전자껍질의 '1s 궤도'에 전자를 1개 가지고 있다. '1s 궤도'에는 최대 2개의 전자가 들어간다. 한편, '산소 원자(O, 원자번호 8번)'은 '2p 궤도'에 전자를 4개 가지고 있다. '2p 궤도'에는 최대 6개의 전자가 들어간다. 이들 궤도가 각각 정원이 가득 차면 더욱 안정되는 것이다.

수소 원자와 산소 원자의 '전자 궤도' 1-3. 물 분자는 정원이 가득 차 있다.
수소 원자 2개와 산소 원자 1개가 결합해 '물 분자'가 되면, 수소 원자와 산소 원자는 합계 4개의 전자를 공유한다. 이렇게 되면, 수소 원자와 산소 원자의 '전자 궤도'는 각각 정원이 가득 차게 된다. 그래서 수소 원자 2개와 산소 원자 1개가 결합하면 안정되는 것이다. 이처럼 원자가 전자를 공유해서 연결되는 결합을 '공유 결합(Covalent Bond)'이라고 한다.
아래의 그림은 수소 원자 2개와 산소 원자 1개가 4개의 전자를 공유해, 물 분자를 형성한 모습이다. 사실 정확하게 말하면, 산소 원자는 2s 궤도와 2p 궤도의 혼성 궤도인 'sp3 혼성 궤도(sp3 hybrid orbital)'를 만들어 수소 원자와 결합한다.
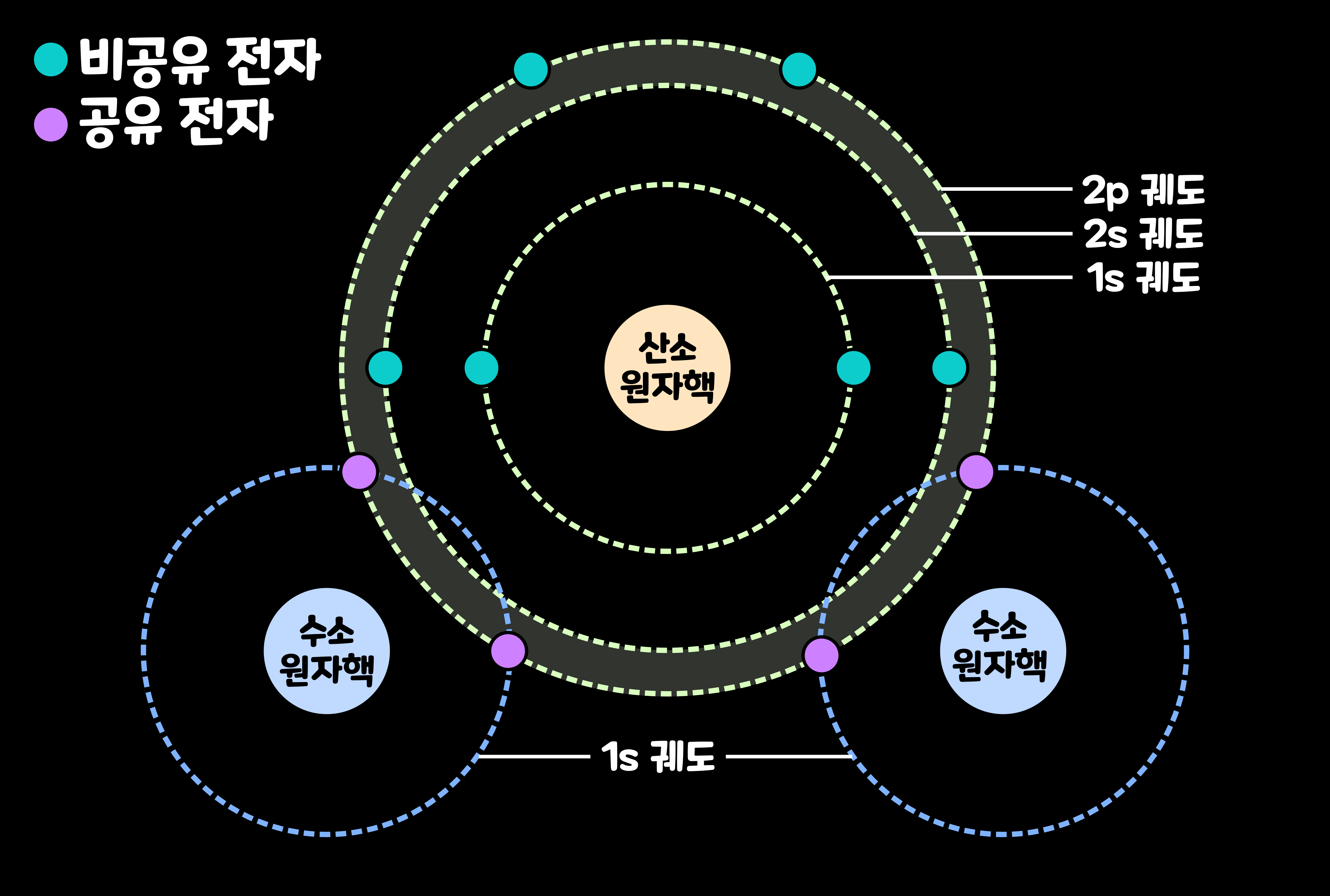
2. 물 분자의 구조
'물 분자(H2O)'는 산소 원자와 수소 원자가 일직선으로 결합한 것이 아니라, 약 104.5˚의 각도를 이룸으로써 물 분자의 전자 궤도가 가장 안정된 상태가 된다. 이 각을 '결합각(Bond Angle)'이라고 한다.
2개의 원자가 전자를 공유해 결합했을 때, '공유 전자(각각의 원자가 공유하고 있는 전자)'를 끌어당기는 정도를 '전기 음성도(electronegativity)'라고 한다. '전기 음성도'가 큰 원자일수록 '공유 전자'를 강하게 끌어당긴다. 산소 원자의 전기 음성도는 3.44, 수소 원자의 전기 음성도는 2.20이다. 즉, 산소 원자의 '전기 음성도'가 크기 때문에 '산소 원자와 수소 원자의 공유 전자'는 '산소 원자' 쪽으로 끌어당겨진다. 그래서 물 분자 속에서, '공유 전자'를 끌어당긴 '산소 원자'는 미미하게 음전기를 띠고 있으며, '공유 전자'와 멀어진 '수소 원자'는 미미하게 양전기를 띠고 있다. 물 분자 전체는 전기적으로 중성이지만 분자 일부에 전하가 치우쳐져 있는 것이다. 이처럼 전체는 전기적으로 중성이지만 부분적으로 전하가 치우쳐져 있는 것을 '분극(polarization)'이라고 한다.

전기 음성도(electronegativity) 3. 수소 결합(Hydrogen Bond)
물 분자가 이어져 물과 얼음이 되는 것은 물 분자끼리의 '수소 결합(Hydrogen Bond)' 때문이다. 그리고 물이 이상한 물질인 이유도, 물 분자끼리 '수소 결합'으로 이어져 있기 때문이다. 2개의 '물 분자(H2O)'가 접근하면 양전기를 띤 부분인 '수소 원자'와, '음전기를 띤 부분인 '산소 원자'가 전기적인 힘으로 서로 끌어당겨 이어진다. 이것이 '수소 결합'이다.
'수소 결합'이 물을 '이상한 물질'로 만드는 이유에는 크게 나누어 두 가지가 있다. 첫 번째 이유는 '수소 결합'에 의해 물 분자끼리 강하게 이어지기 때문이다. 두 번째 이유는 '수소 결합'에 의해 1개의 물 분자가 최대 4개의 물 분자와 이어질 수 있는데, 1개의 물 분자와 수소 결합을 하고 있는 4개의 물 분자가 바로 정사면체의 꼭짓점 위치에 오기 때문이다. '수소 결합'은 '이온 결합'과는 달리, 결합하는 상대의 수와 방향이 정해져 있는 것이 특징이다.
수소 결합을 하는 것은 '산소 원자(O)'와 공유 결합한 '수소 원자', '질소 원자(N)'와 공유 결합한 수소 원자, '플루오린 원자(F)'와 결합한 수소 원자의 3종류이다. 수소 결합의 개념은 1912년에 제창되었으며, 물 분자끼리의 수소 결합은 1920년에 발견되었다.
- 액체의 물: 액체가 용기의 형태에 따라 자유롭게 모양을 바꿀 수 있는 이유는 무엇일까? 그것 은 바로 액체의 경우 분자들이 어느 정도 자유롭게 움직일 수 있기 때문이다. 물속의 물 분자은 운동을 하고 있기 때문에, 다음 순간에는 물 분자의 위치가 바뀐다. 물 분자의 위치가 바뀌면, 물 분자들을 서로 잇는 '수소 결합'도 새로 생기거나 끊어진다. 즉, 물속의 물 분자는 운동하면서 끊임없이 '수소 결합'을 하거나 끊어지기를 반복하고 있다. 어느 순간만을 보면, 액체의 물속에서 1개의 물 분자는 평균 3.6개의 물 분자와 '수소 결합'을 하고 있다.
- 기체의 물: '기체의 물(수증기)'가 된 물 분자는 공중에 휘날린다. 즉, '물의 증발'이란 다른 물 분자와 충돌하는 등의 이유로 우연히 큰 속도를 가진 수면 근처의 물 분자가, 다른 물 분자와의 수소 결합을 뿌리치고 공기 속으로 날아가는 현상이다.
- 고체의 물: 물은 0℃가 되면 '고체의 물(얼음)'이 된다. '얼음'이란 물 분자가 규칙적으로 정렬된 '물의 결정'이다. 얼음 속에서 1개의 물 분자는 4개의 물 분자와 '수소 결합'을 하고 있으며, 1개의 물 분자와 수소 결합을 하고 있는 4개의 물 분자는 정사면체의 꼭짓점의 위치에 있다. 나아가 물 분자가 만드는 정사면체 구조는 다수가 이어져, 정육각형 통 같은 구멍을 만든다. 이것이 얼음의 구조이다. 얼음 속의 물 분자는 물속의 분자에 비해 틈새가 큰 구조를 이루고 있다. 이렇게 물이 얼음이 되면 틈새가 커지기 때문에, 얼음은 부피가 팽창하고 밀도가 낮아진다. 얼음이 물에 뜨는 이유도, 같은 부피로 비교했을 때 얼음이 물보다 가볍기 때문이다.

4. 물의 성질
수소 결합은 물의 여러 가지 '이상한 성질'을 만들어 낸다. 여기에서는 수소 결합이 물의 어떤 특징을 만들어내는지 알아보자.
4-1. 고체인 '얼음'이 액체인 '물'보다 가볍다.
1기압 0℃인 경우, 1cm3의 물의 무게는 약 0.99984g이고, 1cm3의 바닷물의 무게는 약 1.028g이다. 한편, 1cm3의 얼음 무게는 약 0.917g이다. 물질은 액체보다 고체가 무거운 것이 일반적이지만, 물은 기묘하게도 액체보다 고체가 가벼운 물질이다. 고체가 액체보다 가벼운 성질을 가진 물질은 물 이 외에 '규소'와 '티타늄' 등 몇 종류밖에 없다.
액체 속에 있는 고체에 작용하는 '부력(물체를 둘러싼 유체가 물체를 위로 밀어 올리는 힘)'은 그 고체가 밀어내 액체의 무게와 같아진다. 예컨대 1기압, 0℃인 경우, 같은 부피의 바닷물의 무게는 같은 부피 얼음 무게의 약 1.12배이다. 얼음을 모두 바닷속에 가라앉히면 얼음 무게의 약 1.12배의 부력이 얼음에 작용하기 때문에, 얼음이 해수면으로 떠오르게 되는 것이다. 해수면에 놓여진 빙산은 위아래로 움직이다가, 빙산에 작용하는 부력이 빙산의 무게와 균형을 이루면 이윽고 가만히 해수면에 떠 있게 된다. 빙산의 무게와 균형을 이루는 부력을 만드는 바닷물의 부피는 빙산 부피의 '1.12분의 1(약 89%)'이다. 즉, 해수면에 떠 있는 빙산은 부피의 약 89%가 해수면 아래에 있고, 부피의 약 11%만 해수면 위로 나와있다. '빙산의 일각'이라는 말은 이것에서 유래되었다.

4-2. 물은 '녹는점'과 '끓는점'이 아주 높다.
물은 분자 모양이 비슷한 '물의 무리'인 '황화수소(H2S)', '셀레늄화수소(H2Se)', '텔루륨화수소(H2Te)' 등에 비해 '녹는점(Melting point)'과 '끓는점(Boiling point)', '기화열(액체가 기체로 변할 때 필요한 에너지)'이 훨씬 높다. 그 이유는 물 분자들은 튼튼한 '수소 결합'으로 이어져 있는 데 비해 '황화수소(H2S)', '셀레늄화수소(H2Se)', '텔루륨화수소(H2Te)'의 분자들은 '극성 인력'과 '반데르발스 힘(van der Waals force)'으로 이어져 있기 때문이다. 얼음이 녹아 물이 될 때나, 물이 끓어 수증기가 될 때도, 물 분자는 '수소 결합'을 풀어 더욱 자유롭게 움직일 수 있어야 한다. 그런데 '수소 결합'은 '극성 인력'과 '판데르발스 힘'보다 결합력이 강하기 때문에, '수소 결합'을 벗어나기 위해서는 많은 에너지가 필요하다. 그래서 물의 '녹는점'과 '끓는점'이 다른 물 무리에 비해 엄청나게 높은 것이다.
- 녹는점(℃) 끓는점(℃) 기화열(cal/g) 물 0 100 539.43 황화수소 -85.5 -60.7 130.93 셀레늄화수소 -65.73 -24 58.05 텔루륨화수소 -48 -1.8 43.15 4-3. '물의 무리' 이외의 액체와 비교해도 물은 특이하다.
물의 이상한 성질은 '물의 무리' 이외의 액체와 비교해도 두드러지게 나타난다. 예컨대 '표면 장력'이 매우 크다든지, '열전도율'이 매우 높다든지, '비열 용량'이 매우 크다는 성질 등이 있다.
- 표면 장력(Surface Tension): '표면장력'은 액체가 표면적을 작게 하려는 힘이다. '표면장력'이 큰 액체는 '응집력(덩어리가 되려는 힘)'도 크다. 물은 물 분자끼리 수소 결합으로 단단히 이어져 있기 때문에 '표면 장력'이 크다. 키 큰 나무가 물을 나무 위로 빨아올릴 수 있는 이유는 물의 '표면 장력'이 크기 때문이다.
- 열전도율(Thermal Conductivity): '열전도율'은 물질이 열을 전하기 쉬운 정도이다. 물은 물 분자끼리 수소 결합으로 단단히 이어져 있기 때문에 '열전도율'이 높다. 자동차의 엔진 등이 주로 수랭식인 이유는 물의 열전도율이 높기 때문이다.
- 비열 용량(Specific Heat Capacity): '비열 용량'은 1의 물질 온도를 1℃ 올리는데 필요한 에너지이다. 물을 데우기 어렵고 식히기 어려운 이유는 '비열 용량'이 크기 때문이다. 물의 비열 용량이 큰 이유는 액체의 물의 '수소 결합' 구조가 아주 다양하기 때문이다.
- 표면 장력(nM/m) 열 전도율(W/m·K) 비열 용량(cal/g·K) 물 72 0.61 1.00 에탄올 22.39 0.17 0.58 아세트산 25.71 0.19 0.49 부탄올 23.78 0.16 0.57 벤젠 28.88 0.17 0.42 사염화탄소 26.43 0.10 0.20 4-4. 이외에도 물의 이상한 성질은 매우 많다.
지금까지 언급한 물의 이상한 성질은 아주 일부에 지나지 않는다. 물의 이상한 성질을 모두 헤아리면 40가지 이상이 된다고 한다. 그리고 그 특이한 성질의 대부분은 물 분자끼리 '수소결합'으로 이어져 있는 것이 원인이다.
반응형5. '수소 결합'을 하는 다양한 물질들
'물(H2O)' 이외에도 '수소 결합'을 하는 물질들이 있다. 예컨대, 암모니아(NH3)'나 '플루오린화수소(HF)', 술 등에 들어 있는 '에탄올(C2H6O)' 등도 '수소 결합'을 하고 있다.
분자 속에 산소 원자와 수소 원자의 '공유 결합(-OH)'이나, 질소 원자와 수소 원자의 '공유 결합(-NH)', '플루오린 원자와 수소의 공유결합(-FH)'이 있으면, 그 분자는 '수소 결합'을 한다. 예컨대, 에탄올은 분자 속에는 '산소 원자와 수소 원자의 공유 결합(-OH)'이 있다. 그리고 '공유 결합을 하고 있는 산소 원자와 수소 원자'는, 산소 원자가 음전기를 띠고 수소 원자가 양전기를 띠고 있다. 그래서 에탄올 분자끼리 '수소 결합'을 하는 것이다.
5-1. 'DNA'와 '단백질'의 수소 결합
생물은 몸을 이루는 주요 재료인 '단백질(Protein)'과 생명의 유전 정보를 기록하고 있는 'DNA(deoxyribonucleic acid)'도 '수소 결합'을 하고 있는 물질이다. '단백질'은 '아미노산이 염주처럼 이어진 1가닥의 아미노산 사슬이 입체적으로 접혀 만들어진다. 한편, DNA는 '인산(Phosphoric Acid)'과 '당(Sugar)'과 '염기(Base)'로 이루어진 2가닥의 사슬이, 평행으로 늘어서 결합해 있다. '단백질의 아미노산 사슬'과 'DNA의 2가닥 사슬'의 염기에는 '질소 원자와 수소 원자의 공유결합(-NH)'가 많이 있다. 단백질은 입체적인 구조를 유지하기 위해 아미노산 사슬의 여기저기에 '수소 결합'을 하며, DNA는 2가닥 사슬을 묶기 위해 '염기(Base)'끼리 '수소결합'을 한다.
'수소 결합'은 결합을 만들거나 해소하기를 되풀이할 수 있는 아주 튼튼한 결합이다. 그래서 단백질이나 DNA의 '수소 결합'은 단백질이나 DNA가 작용할 때 중요한 역할을 한다. 예컨대, 특정 물질과 결합하는 단백질은 상대와 결합하거나 떨어질 때, '수소 결합'을 이용한다. DNA는 '수소 결합'으로 묶인 2가닥의 사슬을 필요에 따라 부분적으로 풀었다 닫았다 한다.