0. 목차
- 이온은 어떻게 발견되었는가?
- 원자의 구조
- 이온의 정체
- 이온 결합
- 융해
- 어는점 내림
- 순수한 물에는 전기가 통하지 않는다.
- 이온화 에너지
- 이온화 경향
1. 이온은 어떻게 발견되었는가?
1-1. 물이 전기에 의해 수소와 산소로 분해되었다.
사건의 발단은 1800년에 들어서면서, 이탈리아의 과학자 '알레산드로 볼타(Alessandro Volta, 1745~1827)'가 최초로 '전지(battery)'를 발표한 일이었다. 그가 전지를 발표하던 해에, 그 전지의 양 끝에 철사를 물에 담그면 각각의 철사에서 기체가 발생한다는 사실이 알려졌다. 기체를 조사하자, 그것은 이미 발견된 수소와 산소로 판명되었다. 물이 전기에 의해, 수소와 산소로 분해된 것이다.
이 소식을 들은 여러 연구자들은 여러 가지 액체에 전기를 통하는 실험을 했다. '마이클 패러데이(Michael Faraday, 1781~1867)'의 스승이었던 '험프리 데이비(Humphry Davy, 1778~1829)'도 그 가운데 한 사람이었다. 그는 강한 전류를 통하게 하면, 여러 가지 물질이 분해될 것이라고 생각하고, 250개나 되는 전지를 연결해 실험을 했다. 그리하여 '험프리 데이비'는 가열해서 녹인 '포타슈(수산화칼륨)'에 전기를 통하게 하여 '칼륨(K)'을 발견하였다. 데이비는 볼타 전지를 이용한 실험에 의해, 칼륨뿐만 아니라 나트륨, 칼슘, 스트론튬, 바륨, 마그네슘을 발견했다. 생애에 6개의 원소를 발견한 사람은 '험프리 데이비'뿐이다.
1-2. 전기를 통하면 움직이는 것이 '이온'이다.
'볼타 전지(Voltaic Cell)'를 이용한 실험에 의해, 물질은 전기로 분해할 수 있다는 사실이 알려졌다. 하지만 당시에는 전자의 개념도 없었고, 전기는 미지의 현상이었다. 이에 패러데이는 엄밀한 실험을 통해, 전기의 성질을 점차 밝혀냈다. 그리고 패러데이는 전기로 물질이 분해되는 구조를 독자적인 방법으로 설명하였다. 그는 전기가 통하면 물질이 전기의 영향으로 분해된다고 생각했고, 분해된 물질은 전극으로 향한다고 생각했다. 1834년에 '마이클 패러데이'는 전극에 끌려가듯 향하는 물질을 그리스 어의 '간다'는 말을 따서 '이온(Ion)'이라고 이름 붙였다. 나아가 음극으로 가는 물질을 '양이온(Positive Ion)', 양극으로 가는 물질을 '음이온(Negative Ion)'이라고 했다.
하지만 그때 '마이클 패러데이'는 이온의 실체가 무엇인지 알지 못했다. >그 뒤에 이온의 실체가 전기를 띤 '원자' 또는 '원자단(원자의 모임)'임을 밝혀낸 사람은 스웨덴의 '스반테 아레니우스(Svante Arrhenius, 1859~1927)'였다. 그러나 '스반테 아레니우스'의 주장은 받아들여지지 않았다. 왜냐하면 당시 원자는 더 이상 분해할 수 없는 최소 단위로 생각되었을뿐더러, 그것이 어떻게 전기를 지니고 있는지 등을 당시로서는 이해할 수 없었기 때문이다. 하지만 나중에 원자의 구조가 밝혀져, 아레니우스의 생각이 옳았음이 밝혀졌다. 그리고 아레니우스는 그 업적으로 1903년에 노벨 화학상을 받았다.
2. 원자의 구조
'원자는 더 이상 분해할 수 없는 최소 단위'라는 상식을 깨뜨린 사람은 뉴질랜드 태생의 영국 물리학자 '어너스트 러더퍼드(Ernest Rutherford, 1871~1937)'였다.
1896년 프랑스의 물리학자 '앙투안 앙리 베크렐(Antoine Henri Becquerel, 1852~1908)'이 우라늄을 방사선을 내고 있음을 밝혀내자, 많은 물리학자들이 방사선의 정체를 알아내기 위한 실험에 착수했다. '어너스트 러더퍼드'는 1899년에 우라늄에서 나오는 방사선에 두 종류가 있음을 알아내고, 각각 '알파선(α-rays)'과 '베타선(β-rays)'이라고 명명했다. '알파선'은 물질을 투과하기 어렵고, '베타선'은 물질을 투과하기 쉬운 성질이 있었다. 러더퍼드는 '알파선'의 정체가 방사선 물질에서 나오는 입자라고 생각해, 그 입자를 '알파 입자(α-particle)'라고 불렀다.
2-1. 원자핵이 발견되었다.
러더퍼드는 알파선이 물질과 어떻게 작용하는지 조사하는 실험을 했다. 그는 제자들과 함께 얇은 금속막에 알파선을 쬐어, 그것이 어떻게 움직이는지 살펴보았다. 실험에서는 알파선의 대부분이 얇은 금속막을 통과했다. 하지만 실험을 계속하는 가운데, 아주 적기는 하지만 일부는 앞으로 다시 튀어나왔다.
대부분이 금속막을 통과하지만, 아주 소수만 튀어나오는 이유는 무엇일까? 러더퍼드는 그 이유에 대해 원자 속에 원자 크기보다 아주 작지만, 알파 입자보다 무거운 '원자핵(Atomic Nucleus)'이 있는 건 아닐까 생각했다. 이렇게 해서 기본적인 입자라고 생각되었던, 원자에 내부 구조가 존재함이 밝혀졌다. 러더퍼드가 실험 결과를 바탕으로 계산하자, 원자핵의 크기는 원자 크기의 1000분의 1이라는 작은 값이었다.
2-2. 원자핵은 양성자와 중성자로 이루어져 있었다.
러더퍼드의 실험에 앞서, 1887년에 영국의 물리학자 '조지프 존 톰슨(Joseph John Thomson, 1856~1940)'에 의해 '전자(electron)'의 존재가 밝혀졌다. '톰슨'은 '러더퍼드'의 스승이었다. 톰슨의 연구실에서는 러더퍼드를 비롯한 우수한 연구자가 많이 배출되었다. 그 가운데 한 사람이 '중성자(Neutron)'을 발견한 '제임스 채드윅(James Chadwick, 1891~1974)'이다.
물리학자들은 방사능의 정체를 찾아내기 위해 여러 실험을 했다. 그러던 중 1932년에 프랑스의 물리학자 '졸리오 퀴리(Jean Frédéric Joliot Curie, 1900~1958)'가 '베릴륨(Be, 원자번호 4번)' 원자에 '알파 입자'를 충돌시키면, 투과성 높은 정체불명의 방사선이 튀어나옴을 발견하였다.
'채드윅'은 그 방사선의 정체를 찾아 내기 위한 실험을 해서, 그것이 현재는 '중성자'임을 밝혀냈다. 채드윅이 발견한 입자는 질량이 양성자와 거의 같으며, 전하가 0인 입자였다. 이 입자는 전하를 띄지 않아서 '중성자(Neutron)'라고 불리게 되었다. '채드윅'은 그 발견으로 1935년에 노벨 물리학상을 받았다. 그리고 이 발견에 의해, 원자핵이 기본적인 입자가 아니라 '양성자'와 '중성자'로 이루어져 있음이 밝혀졌다. 그리고 '양성자'와 '중성자' 그리고 '톰슨'에 의해 이미 발견된 '전자'가 가장 기본적인 입자라고 생각하게 되었다.
3. 이온의 정체
위에서 설명한 것처럼, 20세기에 들어와 원자의 구조가 밝혀졌다. 원자는 '양성자(Proton)' 및 '중성자(Neutron)'로 이루어진 '원자핵(Atomic Nucleus)'과 '전자(Electron)'로 구성된다. 이 사실이 규명됨으로써 이온의 정체도 밝혀졌다.
모든 원자는 '양성자'의 수와 '전자'의 수가 같다. 하지만 어떤 원자에서는 양성자와 전자의 수가 맞지 않았는데, 이것이 바로 '이온(ion)'이다. 양성자는 '양(+)'의 전하를 가지고, 전자는 '(-)'의 전하를 갖는다. 그래서 양의 전하를 가진 양성자의 수가 음의 전하를 가진 전자의 수보다 많으면, 이온 전체가 양전하를 띠게 된다. 이것이 '양이온(Positive Ion)'이다. 반대로 음의 전하를 가진 전자의 수가 양의 전하를 가진 양성자의 수보다 많으면, 이온 전체가 음전하를 띠게 된다. 이것이 '음이온(Negative Ion)'이다. 예컨대, '산소(원자번호 8번)' 원자는 양성자 8개, 전자 8개를 갖는다. 이에 비해 산소 이온은 양성자 8개, 전자 10개를 갖는다. 전자가 2개 더 많다는 점에서, 산소 이온 전체로는 음의 전하를 갖게 되는 것이다. 이 경우, 전자가 2개 더 많으므로, '2가의 음이온'이라고 표현한다.
3-1. 이온의 법칙
모든 이온은 양성자와 전자의 수가 다르다. 그러면 원자가 이온이 될 때, 전자의 수가 얼마나 증감하는지에 대한 법칙은 없을까? 그 열쇠는 '전자 껍질'에 있다. 전자는 원자핵 주위의 '전자 껍질(Electron Shell)'에 들어 있다. 즉, '전자 껍질'에는 전자가 들어갈 자리가 준비되어 있다. 가장 바깥쪽의 전자 껍질에 있는 자리가 전자로 채워지면 '안정 상태'가 된다는 사실이 알려져 있다.
예컨대 '염소(Cl)' 원자는 가장 바깥쪽 껍질의 빈자리가 1개밖에 없다. 그래서 1개의 전자가 늘어나 음이온이 되면, 빈자리가 채워져 안정된다. 그에 비해 '나트륨(Na)' 원자는 가장 바깥쪽의 껍질에 전자가 1개만 채워져 있고, 나머지 7개는 빈자리다. 그래서 전자가 1개 줄어 양이온이 되면, 가장 바깥쪽 껍질에 있던 1개의 전자가 없어져 안정된다. 전자가 몇 개나 증감해 이온이 되는지는, 가장 바깥쪽 껍질의 빈자리 수에 따라서 결정된다. 주기율표의 세로열은 가장 바깥쪽 껍질에 있는 빈자리의 수가 거의 같기 때문에, 이온이 될 때 전자가 증감하는 수가 대개 같다.
4. 이온 결합
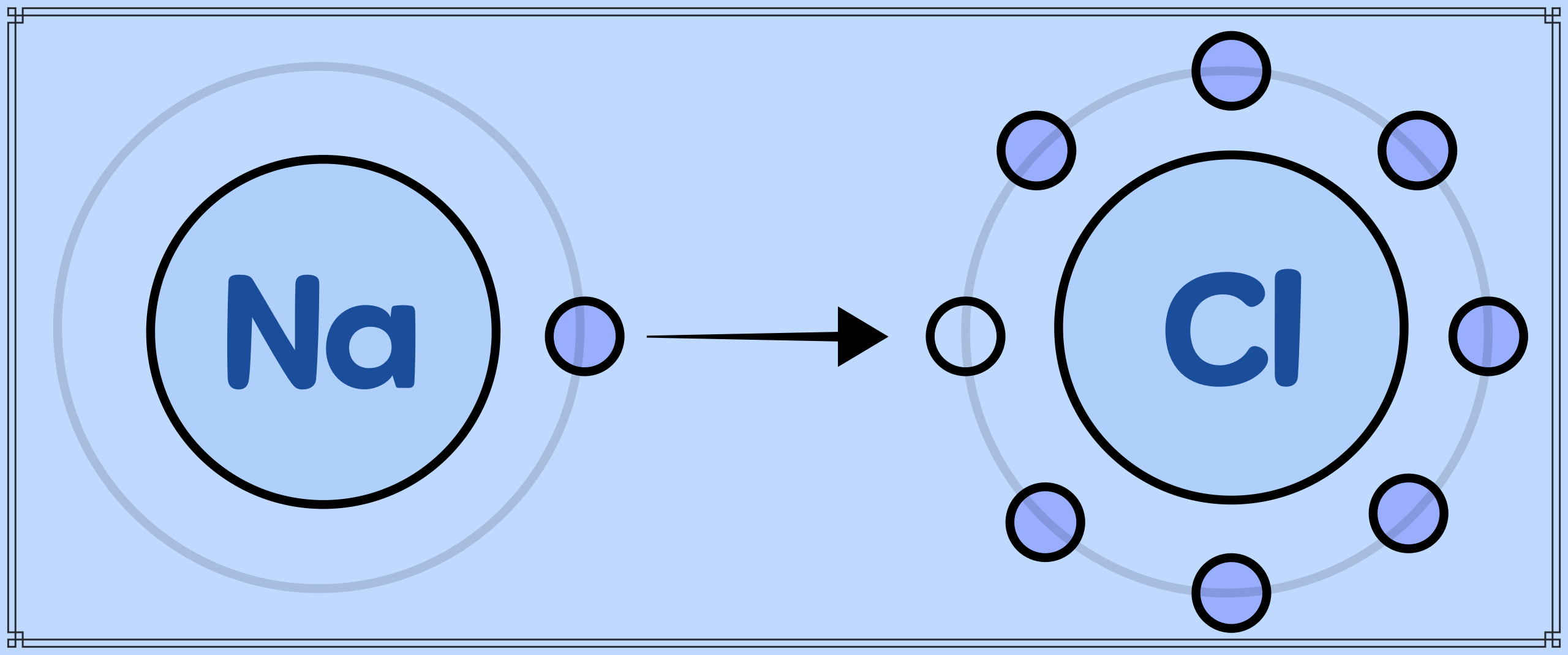
그러면 이온은 왜 생길까? 우리 일상생활에서도 원자는 다른 원자에게 전자를 넘겨주거나 받음으로써 이온이 되어 존재하는 경우가 있다. 예컨대 '소금(NaCl)'은 '나트륨 이온(Na+)'과 '염화 이온(Cl-)'으로 되어 있다. 나트륨 원자는 가장 바깥쪽 전자 껍질에 전자가 1개밖에 없다. 한편, 염소 원자는 가장 바깥쪽 전자 껍질에 전자가 7개 있어, 바깥쪽 전자 껍질에 자리가 하나 비어있다. 그래서 두 원자가 접근하여, 나트륨이 전자 1개를 염소에게 넘기면 더욱 안정된다. 이때, 나트륨 원자는 전자를 하나 잃어 전체적으로는 '양이온'이 되고, 염소 원자는 전자를 하나 얻어 전체적으로는 '음이온'이 된다.
이처럼 양이온과 음이온은 각각 양과 음의 전하로 서로 끌어당겨, 결국 결합하게 된다. 이 결합을 '이온 결합(Ionic Bond)'이라고 한다. 나트륨 이온과 염화 이온도 서로 잡아당겨 결합을 하여 소금이 된 것이다. 소금 외에도 '이온 결합'으로 결합한 물질은 많다. 유리의 재료가 되는 '산화나트륨(Na2O)'이나 충치 예방에 쓰이는 '플루오린화나트륨(NaF)'도 '이온 결합'에 의해 생긴 물질이다.
5. 융해
물에 녹는다는 말은 물 분자와 균일하게 섞인다는 것을 의미한다. 예컨대, 소금물이란 염화나트륨이 녹아 있는 것이 아니라, 나트륨 이온과 염화 이온이 뿔뿔이 흩어져서 물 분자와 섞인 상태를 가리키는 것이다. 소금은 물에 녹으면, 결합해 있어야 할 염화나트륨이 '나트륨 이온'과 '염화 이온'으로 뿔뿔이 흩어진다. 소금물이 짠 이유도 주로 나트륨 이온의 맛을 느끼기 때문이다.
그러면 '나트륨 이온(Na+)'과 '염화 이온(Cl-)'은 서로 결합하고 있는데, 왜 뿔뿔이 흩어질까? 그 이유는 물의 '극성(polarity)'이라는 성질 때문이다. 1개의 물 분자에는 약한 양을 가지는 부분과 약한 음을 가지는 부분이 있다. 이러한 전하의 치우침이 있는 상태를 '극성'이라고 부른다. 물 분자의 극성에 의해 소금과 물은 균일하게 섞일 수 있다. 소금을 물에 넣으면, 주위를 물 분자가 둘러싼다. 양전하를 가지는 나트륨 이온에는 물 분자의 음 부분이 둘러싸고, 음전하를 가지는 염화 이온에는 물 분자의 양 부분이 둘러싼다. 그리고 몇몇의 물 분자가 둘러쌈으로써 소금의 고체에서 이온을 빼 나간다. 이렇게 해서 물 안에 이온이 퍼지고, 소금이 녹게 된다. (물 분자에서 수소 원자 부분이 양 부분이고 산소 원자 부분이 음 부분이다.)

5-1. '비전해질'이라고 물에 녹지 않는 것은 아니다.
소금처럼 물속에서 양이온과 음이온으로 나누어지는 물질을 '전해질(Electrolyte)'이라고 하고, 물속에서 이온으로 나누어지지 않는 물질을 '비전해질(Nonelectrolyte)'이라고 한다.
그런데 물속에서 이온이 되지 않는 '비전해질'이라고 해서, 반드시 물에 녹지 않는 것은 아니다. 물에 녹는 '비전해질'로 '설탕'이나 '포도당' 등을 예로 들 수 있다. '포도당(C6H12O6)'은 탄소 원자, 수소 원자, 산소 원자로 구성된 분자이다. 원자끼리는 '공유 결합'이라는 결합으로 연결되어 있다. 사실 '공유 결합'으로 연결되어 있는 분자는 기본적으로 물에 녹아도 이온이 되기 어렵다. 포도당 분자도 '산소 원자'와 '수소 원자'가 연결되어 있는 부분이 있기 때문에 물 분자와 마찬가지로 '분극(Polarization)'이 일어난다. 그래서 물에 녹을 때, 처음에 물 분자와 포도당 분자가 부분적으로 서로 끌어당기기 시작한다. 소금의 경우와 같이, 포도당 분자가 물 분자에 둘러싸이면, 포도당끼리의 결합이 약해져 결정에서 떨어져 나간다. 이런 식으로 '비전해질'에서도 분자가 '분극(Polarization)이 일어나면 물에 녹을 수 있다.
하지만 분극이 별로 일어나지 않는 '비전해질' 분자는 물에 대부분 녹지 않는다. 예컨대, 탄소와 수소로 이루어진 '벤젠(Benzene)' 등의 유기 화합물이나 기름 등이 있다.
6. 어는점 내림
겨울에는 도로에 '동결 방지제'를 뿌리는 일이 있다. 도로의 물이 얼어서 자동차가 미끄러지는 것을 막기 위해서이다. 소금은 동결 방지제로 사용되기도 한다. 이것은 소금물이 잘 얼지 않는다는 점을 이용한 것이다. 예컨대, 소금을 물에 충분히 녹이면, 그 물이 어는 온도가 -21℃까지 내려간다. 이 현상을 '어는점 내림'이라고 한다.
'어는점 내림(Freezing Point Depression)'은 설탕을 물에 녹여도 일어난다. 하지만 소금과 설탕을 각각 같은 분자 수만큼 물에 녹여 온도를 내리면, 소금은 -2℃까지 온도를 내려야 어는데, 설탕은 -1℃까지만 내려도 언다. 왜 그럴까? 물속에서 녹는 입자의 수가 많을수록, 물은 쉽게 얼지 않게 된다. 즉, 더운 낮은 온도에서 얼게 되는데, 소금 쪽이 녹은 입자의 수가 많은 것이다.
소금은 이온으로 나누어져 물에 녹지만, 설탕은 이온으로 나누어지지 않고 설탕 분자 자체가 물속에 녹는다. 설탕 1분자를 물에 녹이면, 물에 녹은 입자는 1개이다. 한편, 소금 1분자를 물에 녹이면, 나트륨 이온과 염화 이온으로 나누어진다. 따라서 녹은 입자의 수가 더 많은 소금이 어는점을 더 내린다.
7. 순수한 물에는 전기가 통하지 않는다.
'물은 전기가 통하기 쉽다'는 사실은 상식처럼 알려져 있다. 그런데 사실 '순수한 물(물 분자만으로 이루어진 물)'에는 전기가 흐르지 않는다. 일반적인 물에 전기가 흐르는 이유는 이온이 녹아있기 때문이다. 예컨대 수돗물에는 여러 가지 이온이 녹아 있다. 수돗물에는 소금 성분인 '나트륨 이온(Na+)'이나 '염화 이온(Cl-)', '칼륨 이온(K+)' 등 이른바 '미네랄(Mineral)' 성분이 녹아 있다. 그래서 수돗물에는 전기가 통한다. 더욱이 손에 묻은 수돗물에는 앞서 말한 이온에다가, 땀의 성분 등이 이온으로 녹아 있다. 그래서 젖은 손으로 플러그를 잡고 콘센트를 꽂으면, 묻은 물은 전기가 매우 통하기 쉬운 상태여서 감전의 위험이 있다.
'전기(Electricity)'는 전자 등이 이동함으로써 흐르는 것이고, '이온(ion)'은 전자를 주고받음으로써 생기는 것이다. 그래서 이온은 전기를 통하게 하는 역할을 한다. 이온이 음극에서 전자를 받고, 양극에 전자를 넘겨줌으로써 전자가 움직여 전기가 흐르는 것이다. 그런데 사실은 순수한 물에도 높은 전압을 걸면, 아주 미약하지만 전류가 흐르기도 한다. 순수한 물속에도, 미량이지만 물 분자가 '수소 이온(H+)'와 '수산화 이온(OH-)'으로 나누어져 있기 때문인 것으로 생각된다.
8. 이온화 에너지
원자에 따라 이온이 되기 쉬운 정도에 차이가 있다. 이온이 되기 쉬운 정도를 나타내는 지표 가운데 하나가 '이온화 에너지'이다. '이온화 에너지(ionization energy)'는 원자로부터 전자 1개를 빼앗는데 필요한 에너지를 가리킨다. 이온화 에너지가 작을수록 전자를 빼앗기기 쉽고, 양이온이 되기 쉽다.
'소금(NaCl)'을 예로 들어보자. 이온화 에너지가 작은 '나트륨(Na)'은 '염소(Cl)'에게 전자를 넘겨주고 양이온이 된다. 또 '산화칼슘(CaO)'에서는 '칼슘 이온(ca2+)'이 양이온이 되어, '산화 이온(O2-)'과 결합한다. 대개 금속은 '이온화 에너지'가 작고, 양이온이 되기 쉬운 것이 많다. 그에 비해 비금속은 이온화 에너지가 크고, 양이온이 되기 어려운 것이 많다.

8-1. 이온화 에너지는 어떻게 측정하는가?
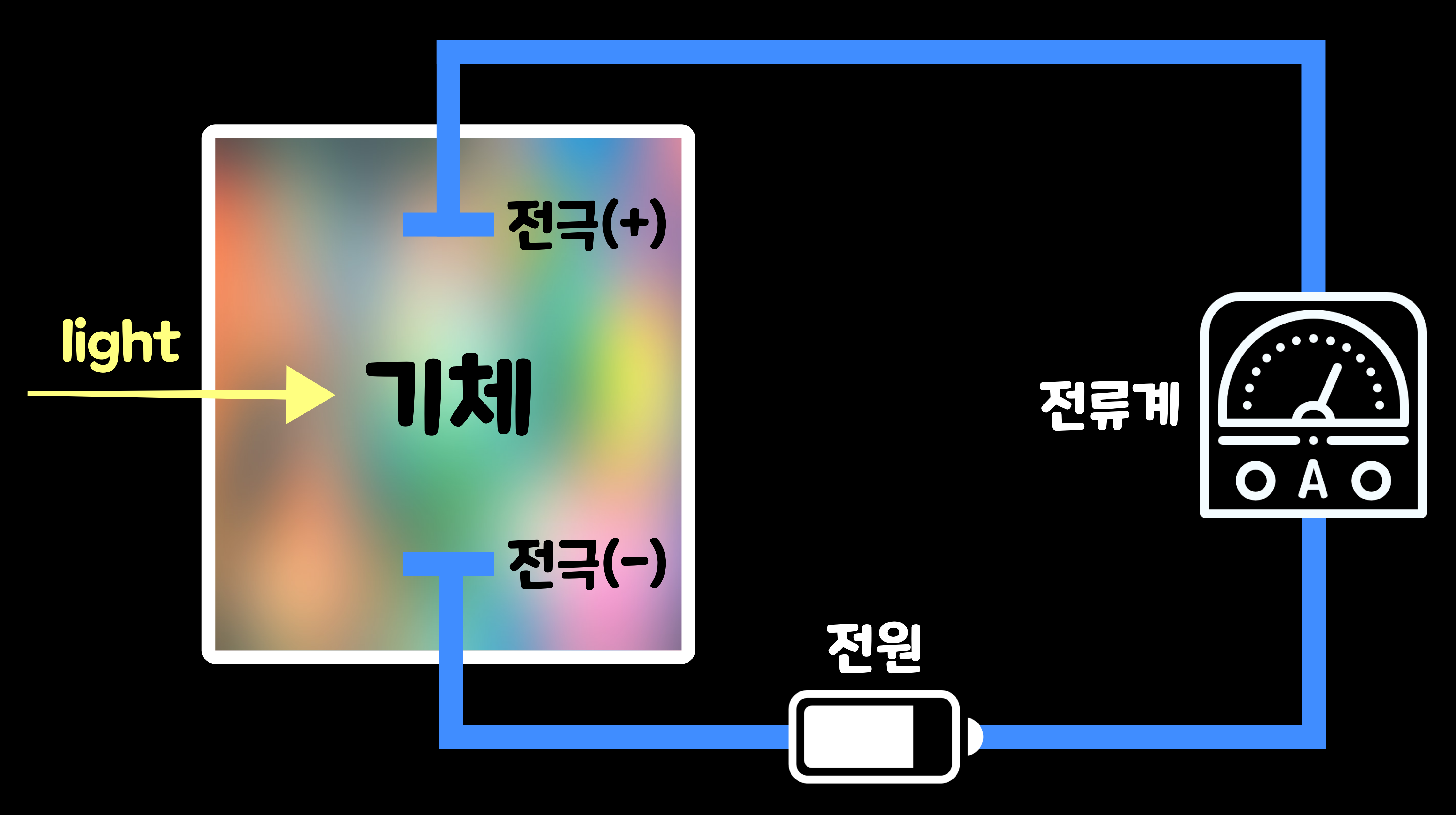
그렇다면 '이온화 에너지(Ionization Energy)'는 어떻게 측정할 수 있을까? 사실 '이온화 에너지(Ionization Energy)'는 기체 상태의 원자가 전자를 방출하기 위해 필요한 에너지를 가리킨다. 따라서 기체에 에너지를 주어, 어느 정도의 에너지로 이온이 되는지를 측정해야 한다. 구체적으로는 빛에너지를 기체 상태의 원자에 주어 측정한다. 아래의 그림은 그 모식도이다. 우선 기체 상태의 원자를 가득 채운 상자에 양극과 음극의 전극을 서치해 전압을 걸어 둔다. 그리고 빛의 에너지를 가해 서서히 크게 해 나가면(파장을 짧게 해 나가면), 어느 순간 기체가 이온으로 바뀌고 전기가 흐른다. 그때의 빛 에너지가 '이온화 에너지이다.
9. 이온화 경향
실은 이온이 되기 쉬운 금속으로부터, 이온이 되기 어려운 쪽으로 전자가 이동함으로써 전기가 흐른다. 금속은 기본적으로 전자를 빼앗기고 양이온이 된다. 금속이 양이온이 되기 쉬운 정도는 '이온화 경향(Ionization Tendency)'이라는 지표로 나타낸다. 특히 이온화 경향의 크기 순으로 금속을 배열한 '이온화 서열'은 전지 등의 금속 반응을 이해하는 데 중요한 열쇠가 된다. 예컨대 '아연(Zn)'과 '구리(Cu)'를 비교해 보자. 이온이 되기 쉬운 '아연' 등의 금속을 수용액에 담그면, 전자를 금속에 남기고 양이온이 되기 때문에, 금속 전체가 음전하를 띤다. 반대로 구리는 이온이 되기 어려우므로, 수용액에 양이온이 있으면 금속이 이온으로 전자를 넘겨주고, 금속 전체가 양전하를 띤다.
그리고 이러한 상태가 된 두 금속을 연결하기만 해도, 음의 금속에서 양의 금속으로 전자가 흐른다. 결국 '전지(Battery)'를 만들 수 있다. 이처럼 '이온화 서열'을 비교하기만 해도 '전지(Battery)'의 메커니즘을 생각할 수 있다. 소금물 안에 집어넣은 두 종류의 금속을 연결하기만 해도 전기가 흐른다. (물론 실제로 아래의 그림처럼 하면, 전기가 약해서 전구에 불이 들어올 만큼의 전기가 흐르지는 않는다.) 이것이 전기의 근본적 메커니즘이다. 더욱이 이온화 경향에 더 차이가 있는 금속을 조합시키면, 높은 전압을 생산하는 전지를 만들 수 있다.

9-1. 이온화 서열
'이온화 경향(Ionization Tendency)'이 큰 순서에 따라 배열한 것을 '이온화 서열(Ionization Series)'이라고 한다. 이온화 경향이 클수록 '양이온(Positive Ion)'이 되기 쉽다.
'수소(H2)'보다 이온화 경향이 큰 금속은 '음극(전류가 흘러 나오는 전극)'이 되기 쉽다. 반대로 '수소(H2)'보다 이온화 경향이 작은 금속은 '양극(전류가 흘러 들어가는 전극)'이 되기 쉽다. 그래서 이들을 조합함으로써 '전지(Battery)'를 만들 수 있다. 이온화 경향의 차가 크면, 그만큼 전압이 높은 전지를 만들 수 있다. 다만, 아래의 그림에서 가장 이온이 되기 쉬운 '리튬(Li)'이나 '칼륨(K)'은 물과 폭발적으로 반응해 이온이 된다. 따라서 매우 위험하기 때문에, 수분을 함유하는 형태의 전지에는 사용하기 어렵다.

9-2. 이온화 경향은 수소를 기준으로 측정한다.
그러면 '이온화 경향(Ionization Tendency)'는 어떻게 측정할까? 이온화 경향은 '수소(Hydrogen)'를 기준으로 측정할 수 있다. 측정에는 수소 가스를 이용한 '수소 전극(Hydrogen Electrode)'을 사용하며, 측정값은 '표준 전극 전위(Standard Electrode Potential)'라고 한다. 측정값은 수소 가스와 측정하고자 하는 금속 중 어느 쪽이 이온이 되기 쉬운지를 비교한 값이다.