0. 목차
- 녹의 구조
- 몸 속의 이온
- 표백제(Bleaching Agent)
- 산과 염기
1. 녹의 구조
1-1. '산화'와 '환원'
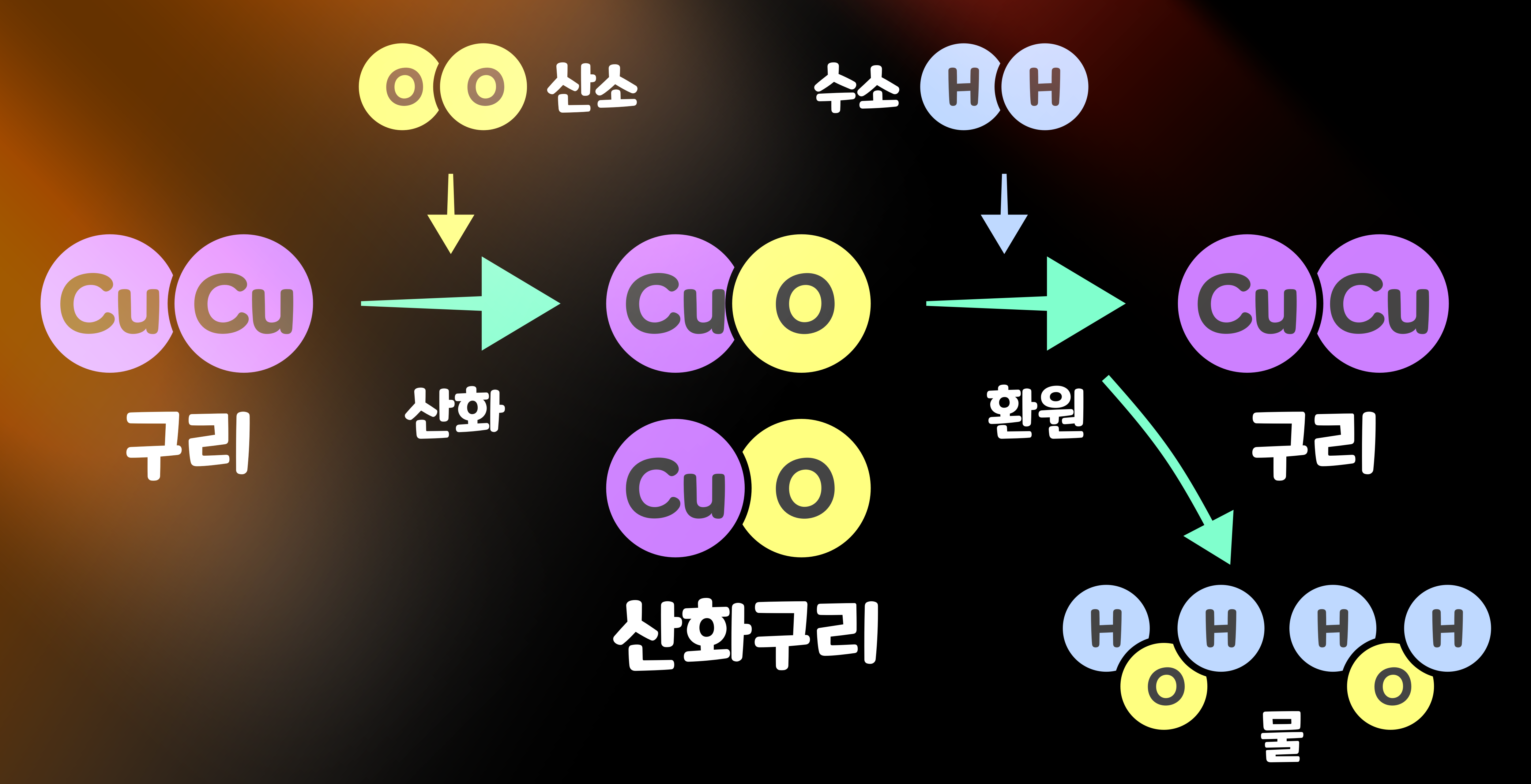
'구리(Cu)'에 '산소(O2)'를 뿜으면서 가열하면, '구리'는 '산화'해 '산화구리(CuO)'가 된다. '산화(Oxidation)'는 넓은 의미에서는 '전자를 잃는 것(전자를 넘겨주는 것)'을 의미하지만, 우리 주변에서 일어나는 산화의 다수는 '산소 원자와 결합하는 것'을 말한다.
그리고 '산화구리(CuO)'에 '수소(H2)'를 뿜으면서 가열하면, 산화구리는 '환원'해 '구리(Cu)'로 되돌아간다. '환원(Reduction)'은 넓은 의미에서는 '전자를 뺏는 것(전자를 얻는 것)을 의미하지만, 우리 주변에서 일어나는 환원의 다수는 '수소 원자와 결합하는 것'을 말한다. 환원이라는 말은 산화물에서 산소를 제거하고 원소로 환원한다고 하는 의미에서 생겼다. 이 과정에서 '물(H2O)'이 생긴다.
1-2. 이온이 흘러나오는 것에서 철의 녹이 시작된다.
'녹(Rust)'은 '산화'라는 현상이다. '산화(Oxidation)'는 넓은 의미에서는 '전자를 잃는 것(전자를 넘겨주는 것)'을 의미하지만, 우리 주변에서 일어나는 산화의 다수는 '산소 원자와 결합하는 것'을 말한다. 예컨대, '산소(O2)' 가스에서 '구리(Cu2)'를 가열하면, '산화구리(CuO)'가 된다. 이것이 산화이다. 하지만 가열하는 실험과는 달리, 우리 주변에서 흔히 보는 녹의 경우, 약간 복잡한 반응이 일어난다.
철의 녹을 예로 살펴보자. 철은 빗물 등에 달라붙으면, 우선 철 이온이 녹는다. 그와 동시에 물 분자(H2O)'와 물에 녹은 분자 '산소 분자(O2)'가 전자를 받고, 철 이온과 결합해서 붉은색의 '수산화철[Fe(OH)3]'로 변한다. 녹슨 철관을 통과한 물이 붉어질 때, 그 색깔의 정체 중 하나가 '수산화철'이다. 또 물속의 산소 분자와 반응하고 '산화철(Fe2O3)'로 변해 금속 표면에 달라붙는다. 이것이 녹의 정체이다. 철이 녹슬면 표면이 울퉁불퉁한 상태가 되는 것은, 철 이온이 녹아 나오고 이어서 붉은 녹이 표면에 달라붙기 때문이다.
1-3. 녹 제거제
철의 녹이 '산화'에 의한 것이라면, 시판되고 있는 '녹 제거제'의 원리는 환원 반응을 이용한 것일까? 사실 일반 가정에서 철의 녹 등을 제거하기 위해 사용하는 것은 환원제가 아닌 경우가 많다. 환원제는 그 자신이 '산화되기 쉬워(전자를 잃기 쉬워), 반원 상대를 환원하는 작용을 지닌다. 주요 환원제로는 '나트륨(Na)', '아연(Zn)' 수소(H2)' 등을 들 수 있다.
그러면 녹 제거제의 다수가 '환원제'가 아닌 이유는 무엇일까? 그것은 철이 녹슬 때, 철 이온이 녹아 나오거나, 철의 표면 위에 붉은 녹이 달라붙으면 표면이 울퉁불퉁해지기 때문이다. 즉, 환원제로 환원하기만 해서는 그 울퉁불퉁한 것을 되돌릴 수가 없다. 그래서 녹 제거제의 경우, '산(acid)'으로 철의 표면을 녹임으로써 동시에 녹까지 없앴다.
2. 몸 속의 이온
이온의 우리 몸속에서도 여러 가지 중요한 역할을 하고 있다.
2-1. 이온이 없으면 세포가 파열된다.
사람의 몸은 약 270종, 60조 개의 세포로 이루어져 있다. 세포들은 이온을 교묘하게 이용하고 있다. 구체적으로 어떻게 이용하고 있을까?
세포는 끊임없이 이온을 세포 밖으로 배출하고 있다. 만약 이 이온의 배출이 멈추면, 많은 물이 세포 속으로 들어가 세포가 파열되어 버릴 것이다. 세포 속에는 세포가 작용하기 위해 필요한 여러 가지 물질이 들어 있어, 농도가 짙은 상태이다. 물은 물질이 희박한 쪽에서 진한 쪽으로 흐르는 성질이 있다. 그래서 그대로 두면 삼투에 의해, 농도가 낮은 밖에서 농도가 높은 세포 안으로 물이 들어온다. 그것을 막기 위해, 세포에서는 나트륨 이온을 끊임없이 밖으로 퍼내고 있다. (참고로 나트륨 이온은 세포 활동에 필요한 물질의 출입과 더불어 세포 안으로 들어오기 때문에, 없어지지는 않는다.)
2-2. 혈액 속에서 이온은 여러 가지 중요한 역할을 한다.
사람의 몸속을 돌고 있는 혈액은 '동맥'에서 '모세혈관'으로 흐르고, 이어 '모세혈관'에서 '조직액'이되어 '세포의 틈으로 흐른다. 인체를 구성하고 있는 약 60조 개의 세포 살 수 있는 이유는 혈액과 조직액이 산소나 영양소를 운반해 주기 때문이다.
물을 주성분으로 하는 혈액에는 '염화나트륨(NaCl)'이나 단백질, 아미노산, 지질, 당, 무기질, 요소, 요산, 암모니아 등 많은 물질이 녹아 있다. 이들 물질은 물 분자와 서로 끌어당기며 물에 녹아있다. 한편, 조직액은 '혈장(혈액에서 적혈구, 백혈구, 혈소판을 뺀 액체)'과 비슷한 액체이며, 혈장에 비해 단백질의 함유량이 약간 적다. 혈액이나 조직액에 다양한 물질이 녹아 있는 이유는, 혈액이나 조직액의 주성분인 물이 용해력이 크기 때문이다.
2-2-1. 염화나트륨의 역할
'염화나트륨(NaCl)'과 같은 '전해질'은 혈액 속에서 '나트륨 이온(Na+)'과 '염화 이온(Cl-)'로 분해된 채 녹아 있다.
- 나트륨 이온: '나트륨 이온'은 혈액 속의 주된 양이온이며, '물 분자 속의 음전하 부분(산소 원자)'과 서로 끌어당기며 물에 녹아 있다. '나트륨 이온'은 정상적인 수분의 유지와 삼투압의 유지에 관여하고 있으며, 고혈압과 상관관계가 있다고 한다. 오랜 기간에 걸쳐 혈액 속의 나트륨 이온 농도가 상승하면, 삼투압의 평형을 유지하기 위해 혈장 용적이 늘어나 벽을 팽창시킴으로써 혈압을 상승시킨다.
- 염화 이온: '염화 이온'은 혈액 속에 가장 많이 존재하는 음이온이며, '물 문자 속의 양전하 부분(수소 원자)'와 서로 끌어당기며 물에 녹아 있다. '염화 이온'은 수분과 삼투압의 유지나 양이온과 음이온의 정상적인 평형을 유지하는 중요한 역할을 한다. 또 고혈압의 원인이 된다는 설도 있다.
그 외에도 혈액 속에는 칼륨 이온, 칼슘 이온, 마그네슘 이온, 인산수소 이온 등 많은 이온들이 중요한 역할을 하고 있다.
2-3. 뇌에서는 이온을 이용해 신호를 전달한다.
뇌의 신경 세포에서는 일시적으로 나트륨 이온을 세포 속에 유입시켜 신호를 전달한다. 우리가 생각을 하거나 손을 움직이기 위한 뇌에서의 여러 가지 신호는 신경세포에 나트륨 이온이 흐름으로써 전해진다.
- 보통 때는 세포 밖으로 이온을 배출: 정보를 전달할 필요가 없을 때는, 다른 세포와 마찬가지로, 세포 안에 있는 나트륨 이온을 배출한다. 그래서 세포 안은 '음(-)', 세포 밖은 '양(+)'의 상태로 되어 있다.
- 신호를 받으면, 이온이 유입: 신경세포에서는 전류를 감지하면, 이웃의 나트륨 이온채널이 새로 나트륨 이온을 세포 안으로 유입시킨다. 그 결과, 그 부근의 세포 안은 '양(+)', 세포 밖은 '음(-)'이 되어, 세포의 내부에서는 국소적인 전류가 발생한다. 이러한 반응이 이어짐으로써, 말단까지 전기 신호가 전달된다.
- 이온을 배출하고 원래 상태로 복귀: 신호 전달이 끝나면, 곧 다시 나트륨 이온을 세포 밖으로 배출해 원래의 상태로 돌아간다. 이때 이온을 배출하는 데 시간이 걸리기 때문에, 신호를 받더라도 반응할 수 없는 '불응기(Refractory Period)'라는 시간이 있다.
2-4. 위에서는 수소 이온의 힘으로 음식물을 소화한다.
이온은 몸속에서 음식물을 소화하는 데에도 이용된다. 위 속에는 '위산(Gastric Acid)'이라는 산이 있다. 또 위 안에서는 '염산(HCl)'도 분비되고 있다. '염산(HCl)'은 '수소 이온(H+)'과 '염화 이온(Cl-)'이 물에 녹은 것이다. 위 속에서는 주로 단백질이 분해되는데, 이때 염산이 꼭 필요하다. 다만, 단백질을 잘라서 직접 분해하는 것은 '염산'이 아니라 '펩신(Pepsin)'이라는 물질이다. '펩신'은 단백질 분해 효소의 일종으로, 펩신이 위에서 분비될 때는, 단백질 분해 능력이 없다. 왜냐하면 위 속에서 분비되기 전에 그 능력이 있다면, 몸의 구성 성분이 분해되기 때문이다. 즉, 위 자체가 소화된다. 그래서 위벽에서는 분해 능력이 없는 펩신과 염산이 따로 분비된다. 그다음에 위 안에서 섞임으로써, 펩신은 단백질을 분해하기 시작한다. 펩신은 '수소 이온(H+)'과 만나야 비로소 단백질 분해 능력을 갖게 되는 것이다.
더욱이 물고기나 고기 등에 포함되어 있는 단백질은 그대로 분해되기 어렵다. 단백질은 아미노산이 끈 모양으로 이어진 물질로, 끈이 복잡하게 얽힌 구조로 되어 있다. 펩신은 가위처럼 단백질의 끈을 절단하는데, 한 가닥씩밖에는 자를 수 없다. 그래서 끈을 풀지 않으면, 여간해서는 분해가 되지 않는다. 그런데 수소 이온이 음식물의 단백질과 결합하면, 단백질의 구조가 바뀌게 되어 끈을 느슨한 상태로 만들 수 있다. '수소 이온'에 의해 음식물의 단백질 구조가 느슨해지면, 여기에 펩신이 분해 능력을 발휘하여 음식물의 단백질이 분해되는 것이다.
3. 표백제(Bleaching Agent)
가정에서 사용되는 세탁용 '표백제(Bleaching Agent)'가 의류 등의 때를 벗기는 것은 어떤 원리일까? 그 구조를 살펴보자. 표백제에는 여러 종류가 있고, 각각이 특징이 서로 다르므로, 용도에 맞게 사용해야 한다.
'산화형 표백제'에는 '하이포아염소산(하이포아염소산 이온, 수소 이온)' 등이 들어 있다. 표백제를 사용하면 '하이퍼염소산 이온'이 때의 분자에 접근한다. 이 '하이포아염소산 이온'은 다른 분자를 산화하는 매우 강한 성질이 있다. 그래서 의류 등에 달라붙은 때 분자 안에 있는 결합을 절단하고, 산소를 결합시킬 수 있다. 그러면 절단된 분자는 구조가 바뀌어 버려 색깔을 잃는다. 이렇게 해서 표백이 이렇게 이루어진다. 즉, 표백제는 세제와 달리 때를 제거하는 것이 아니다. 그리고 산화하는 힘이 강해, 의류에 금속이 붙어 있으면, 녹의 원인이 되므로 주의가 필요하다.
4. 산과 염기
4-1. 산과 염기가 만나면 '염'이 생긴다.
'산(Acid)'과 '알칼리(Alkali)'가 만나면, 그 어느 것과도 성질이 다른 '염(Salt)'이 생긴다. 원래 '염(Salt)'이란 산인 '염산(HCl)'과 알칼리인 '수산화나트륨(NaOH)'을 섞으면 '염화나트륨(소금)'이 생기는 것에서 붙여진 이름이다. '산의 음이온(염화 이온)'과 '알칼리의 양이온(나트륨 이온)'이 '이온 결합'을 하면, 염인 '염화나트륨'과 '물'이 생긴다. 이렇게 산과 염기가 하는 반응을 '중화(Neutralization)'라고 한다.
그러면 '산(Acid)'과 '알칼리(Alkali)'의 반응으로 생긴 염에 다시 산을 가하면 어떻게 될까? 먼저 약한 산과 염기를 반응시켜도 염이 생긴다. 그러나 그 염에 다시 강한 산을 더하면, 약한 산은 분리되고, 강한 산과 염기가 반응해 생기는 염이 생긴다. 예컨대, 먼저 약한 산인 '아세트산(CH3COOH)'과 '수산화나트륨(NaOH)'을 섞으면, '아세트산나트륨(CH3COONa)'이라는 염이 생긴다. 그리고 그 염에 강한 산인 '염산(HCL)'을 가하면, '아세트산(CH3COOH)'은 분리되고, '염산(HCl)'과 '수산화나트륨(NaOH)'이 반응할 때 생기는 염인 '염화나트륨(NaCl)'이 생긴다.
4-2. 세제를 섞으면 위험한 이유
대부분의 '염소계 세제'에는 '하이포아염소산나트륨(NaOCl)'이라는 물질이 들어 있다. '하이포아염소산나트륨'은 '하이포아염소산(하이포아염소산 이온, 수소 이온)'이라는 산과 '수산화나트륨(NaOH)'같은 알칼리가 만나 생기는 '염(Salt)'이다. 그런데 거기에 주로 염산이 성분인 산성 세제를 가하면, 격렬한 반응이 일어난다.
약한 산인 '하이포아염소산(ClHO)'과 알칼리인 '수산화나트륨(NaOH)'으로부터 생긴 염에, 강한 산인 '염산'을 가하면, 약한 산은 분리되고, 강한 산과 알칼리인 '염화나트륨(NaCl)'이 생긴다. 그런데 여기에서 분리되는 약한 산 '하이포아염소산'은 매우 분해되기 쉬운 성질이 있다. '하이포아염소산'이 강한 산인 '염산'의 '수소 이온'에 의해 '물'과 염소 가스'로 분해된다. 이 반응은 순식간에 진행되며, '염소 가스'는 부글부글 거품을 일으키며 공기 속으로 방출된다. 염소 가스는 우리 몸에 매우 위험한 가스이기 때문에, 들이쉬면 순식간에 의식을 잃고 목숨을 잃을 수도 있다. 그래서 이런 위험이 있은 염소계 세제나 산성 세제에는 '섞으면 위험'이라고 적혀 있다. 우연히 식초가 뿌려진 주방의 싱크대에서, 산성 세제를 사용해 청소를 했던 변기에 염소계 세제를 사용하면, 목숨을 잃는 사고가 일어날 수도 있다.