-
주기율표와 원소과학(Science)/화학 (Chemistry) 2021. 9. 22. 12:38
0. 목차
- 원소를 찾아서
- 성질이 제각각인 원소를 어떻게 정리할 것인가?
- 원소를 질량순으로 정리하다.
- 주기율표의 탄생
- 최신 주기율표
- 동위 원소(isotope)
- 전자껍질(Electron Shell)
- 같은 족의 원소가 비슷한 성질을 나타내는 이유

1. 원소를 찾아서
1-1. 새로운 원소를 찾아서
1669년 독일의 연금술사 '헤니히 브란트(Hennig Brand, 1630~1692)'는 사람의 소변을 대량으로 끓이고 있었다. '연금술사'란 '철(Fe)'이나 '납(Pb)' 등의 값싼 금속을 달구거나 뭔가를 섞어서 '금(Au)'같은 값비싼 금속을 만들려고 했던 사람을 말한다. '헤니히 브란트'도 그 같은 연구의 하나로 소변을 분석하고 있었다. '브란트'는 소변을 펄펄 끓임으로써 검은 침천물을 얻었는데, 그 침전물에 더욱 강한 열을 가하자 하얀색 물질로 변하고, 나아가 밝게 빛났다. 나중에 이 현상은 소변에 포함되어 있던 '인(P)'이 발화한 것이라는 사실이 밝혀졌다. 이것은 인류가 새로운 '원소'를 발견한 최초의 명확한 기록이다. 아래의 그림은 그때의 광경을 상상하여 그린 것이다.
브란트가 '인(P)'을 발견한 17세기 당시 '원소(element)'라는 개념은 아직 확립되어 있지 않았다. 인류는 금이나 황 등 자연에 존재하는 원소를 무의식적으로 발견해 이용하고 있었지만, 그들은 이것을 원소라고 인식하지는 않았다.
1-2. 원소의 개념이 확립되다.
현대와 같은 '원소'의 개념은 18세기 후반에 확립되었다. 프랑스의 화학자 '앙투안 라부아지에(Antoine-Laurent de Lavoisier, 1743~1794)'는 공기가 둘 이상의 기체의 혼합물임을 알아냈으며, 공기 속에서 원소인 '산소(O)'를 발견했다. 그리고 1789년에 발표한 '화학 요론'에서 원소를 '더 이상 분해할 수 없는 단순한 물질'이라고 정의했다.
'라부아지에'가 활약한 18세기는 '금(Au)', '은(Ag)', '구리(Cu)', '산소(O)', '질소(N)' 등 30종 정도의 원소밖에 알려지지 않았던 시대였다. 하지만 이후 과학자들이 물질을 철저하게 분해해 새로운 원소를 탐구하였다. 그 결과, 2021년 현재 인류가 발견한 원소는 118종에 이르게 되었다.
반응형2. 성질이 제각각인 원소를 어떻게 정리할 것인가?
18세기 이후, 차츰 새로운 원소가 발견되고 밀도, 녹는점, 여러 가지 물질과 반응하기 쉬운 정도 등이 조사되었다. 그러면 성질이 제각각인 원소를 어떻게 정리해야 할까? 이에 1805년, 영국의 화학자 '존 돌턴(John Dalton, 1766~1844)'은 원소끼리 서로 비교하기 위한 획기적인 지표를 발표하였다. 그것은 바로 원소의 질량이다.
당시는 '물(H₂O)'이 '수소(H)'와 '산소(O)'로 이루어져 있다는 사실을 알려져 있었다. 라부아지에가 수소와 산소를 섞고 불을 붙이면 물이 생긴다는 내용을 발표했기 때문이다. 게다가 물이 생길 때 소비되는 수소와 산소의 질량 비는 항상 일정했다. 그래서 돌턴은 수소와 산소에 '최소 단위의 알갱이'가 있고 그 알갱이가 항상 같은 비율로 결합해 물이 생긴다고 생각했다. 돌턴이 생각한 최소 단위의 알갱이는 '원자'였다. 나아가 같은 종류의 원자는 어느 것이나 같은 질량을 갖는다고 생각했다. 예컨대 수소라면 어떤 수소든지 질량이 같다는 것이다. 현재는 원자의 질량을 '원자량'이라고 부르고 있다.
2-1. 원자와 원소의 차이
그런데 '원자(Atom)'와 '원소(Element)'의 차이는 무엇일까? 흔히 '원자(Atom)'과 '원소(Element)'를 혼동해서 사용하는 경우도 적지 않지만, 사실 '원자'와 '원소'의 개념은 명확하게 다르다. '원자(Atom)'는 개수의 개념이고, '원소(Element)'는 종류의 개념이다. 즉, 한마디로 원소는 '원자의 종류'이다.
- 원자(Atom): '원자'는 '물질을 구성하는 구체적인 요소'이다. 즉 '원자(Atom)'는 물질을 구성하는, 실체가 있는 입자이다. 예컨대 '수소 분자'라는 물질을 구성하는 입자는 '수소 원자'이다.
- 원소(Element): '원소'는 원자의 '성질을 나타내는 추상적인 개념'이다. 자연계를 보면, 수소 원자는 '수소 가스(H2)' 외에도 '물(H2O)', '메탄(CH4)' 등 다양한 상태로 존재한다. 그들 모든 상태를 포함해 생각한 수소라는 개념이 원소이다.
반응형3. 원소를 질량순으로 정리하다.
돌턴은 아부아지에의 실험 결과를 바탕으로 수소 원자의 질량을 1이라고 할 때 산소 원자의 질량을 7이라고 추정했다. 하지만 실제 산소의 원자량은 16이다. 이것은 돌턴이 물 분자를 수소 원자 1개와 산소 원자 1개로 이루어진 'HO'라고 잘못 생각했기 때문이었다. 이런 오류가 있었음에도 불구하고, 돌턴은 몇 가지 원소의 원자량을 발표했다. 이후 여러 가지 원소를 질량이라는 공통 지표로 정리하고 분석할 수 있게 되었다.
3-1. 카를스루에 국제 화학회의
1860년 9월에는 독일 '카를스루에(karlsruhe)'에서 제1회 국제 화학회의가 열렸다. 당시 유럽의 과학자들은 이 회의에서 '원소를 원자량에 근거해 어떻게 정리해야 하는가?'에 대해 논의했다. 하지만 원소를 정리하려고 해도 측정한 과학자들마다 원자량의 값이 제각각이었다. 그래서 회의에서 원자량을 구하는 방법이 협의되었고, 당시 알려져 있던 60개의 원소에 대해 가장 옳다고 생각되는 원자량의 값이 발표되었다.
3-2. 원소를 원자량이 작은 순서로 배열하면, 비슷한 성질이 주기적으로 나타난다.
원소들은 모양이나 성질이 모두 제각각인 것처럼 느껴진다. 하지만 '질량(원자량)'이라는 기준으로 원소를 배열하면, 규칙성이나 패턴이 보이기 시작한다. 카를스루에 국제 화학회의가 열리고 나서 2년 후인 1862년, 프랑스의 지질학자 '베귀에 드 샹쿠르투아(1820~1996)'는 원자량이 16 커질 때마다 비슷한 성질을 가진 원소가 나타난다는 규칙성을 찾아냈다. 예컨대, '리튬(Li, 원자량 7)', '나트륨(Na, 원자량 23)', '칼륨(K, 원자량 39)'처럼 비슷한 성질을 가진 원소가 나타난다는 사실을 발견했다. 이 세 원소는 녹는점이 낮고 유연한 금속으로 물 등과 격렬하게 반응한다는 아주 비슷한 성질을 가지고 있다.
1864년에는 영국의 화학자 '존 뉴랜즈(John Alexander Reina Newlands, 1837~1898)'가 원자량이 작은 원소부터 차례로 번호를 붙여나가면 8마다 비슷한 성질의 원소가 나타난다는 법칙을 발표했다. 예컨대, '리튬(Li, 원자 번호 2번)', '나트륨(Li, 원자 번호 9번)', '칼륨(Li, 원자 번호 16번)' 같은 식이다. 이 법칙은 '옥타브 규칙(Octave Rule)'으로 명명되었다. 하지만 옥타브 규칙은 모든 원소에 해당하는 것은 아니라, 과학자들에게 널리 인정받지는 못했다.
반응형4. 주기율표의 탄생
1869년에는 러시아 상트페테부르크 대학의 화학 교수였던 '드미트리 멘델레예프(Дмитрий Иванович Менделеев, 1834~1907)'가 원소 분류표의 결정판이라고 할 수 있는 '주기율표(Periodic Table)'를 발표하였다. '드리트미 멘델레예프'는 당시 집필 중인 화학 교과서에서 원소를 어떻게 소개할지 고민하고 있었다. 당시에는 63개의 원소가 발견되어 있었고 성질이 닮은 원소들이 있다는 사실은 알려져있었는데, 아무도 이를 명확하게 정리하지 못하고 있었다.
그러던 어느날, 멘델예프는 원소의 무게와 자기가 좋아하는 카드 게임의 연관성에 생각이 미쳤다. 그 게임은 하트나 스페이드 등의 숫자가 커지도록 배열된 것이었다. 멘델레예프는 하얀 종이 카드를 꺼내서 원소의 이름과 원자량 등을 기록했다. 그리고 비슷한 성질의 원소 그룹마다 원자량이 커지는 순서대로 배열했다. 몇 번이나 배열을 바꾸어 나가다가 마침내 '원소 주기율표'가 완성되었다. 하지만 멘델레예프가 주기율표를 처음 발표할 당시에는 과학자들로부터 인정받지 못했다.

화학자 '드미트리 멘델레예프' 4-1. 성질이 비슷한 원소를 같은 행에 배열했다.
멘델레예프는 가장 가벼운 수소를 출발점으로 해서 원소를 원자량 순으로 세로로 배열하였다. 그리고 적절한 곳에서 다음 열(세로줄)로 옮겨가, 비슷한 성질의 원소가 같은 행(가로줄)에 위치하도록 배열하였다. 예컨대 '리튬(Li)'의 열은 '플루오르(F)'에서 끝나고, '나트륨(Na)'에서 새로운 열이 시작된다. 이렇게 해서 '리튬과 나트륨', '플루오린과 염소(Cl)'등 비슷한 성질을 가진 원소가 가로로 배열된다.
4-2. 발견되지 않은 원소는 빈칸으로 남겨두었다.
1860년대에는 원소의 분류표가 몇 가지 제안되어 있었다. 하지만 그중에서도 멘델레예프의 주기율표가 뛰어났다. 멘델레예프의 주기율표에서는 성질이 비슷한 원소가 어떤 주기로 나타나는지를 완전히 파악했을 뿐만 아니라, 발견되지 않은 원소를 빈칸으로 남겨두었다. 즉, 멘델레예프는 앞으로 발견될 미지의 원소까지 예언한 것이다.
예컨대, 그는 1871년에 '칼슘(Ca, 원자번호 20번)'과 '티타늄(Ti, 원자번호 22번)'사이에 원자량 44인 원소가 존재할 것으로 예측하였는데, 실제로 1879년에 원자량이 44.96인 '스칸듐(Sc, 원자번호 21번)'가 발견되었다. 스칸듐 말고도 그가 예측한 원소 가운데 3개는 그가 살아 있는 동안에 발견되었고, 그 성질도 예상대로였다. 멘델레예프의 '예언'이 들어맞음으로써 멘델레예프의 주기율표는 인정을 받기 시작했고, 주기율표의 우수성이 증명되었다.
4-3. 주기율표가 확장되어 가기 시작하다.
하지만 1894년에는 '비활성 기체'로 불리는 '아르곤(Ar, 원자번호 18번)'이라는 원소가 발견되면서, 멘델레예프의 주기율표는 재검토되어야 했다. 아르곤뿐만 아니라, 또 몇 년 사이에 '네온(Ne)' 등 다른 비활성 기체도 발견되었다.
비활성 기체는 다른 물질과 반응하기 어렵고, 그때까지 발견된 원소와는 전혀 다른 성질을 가지고 있었다. 그래서 기존의 주기율표에 비활성 기체를 넣기가 어려웠다. 과학자들은 이를 어떻게 해야 할지 고민했고, 멘델레예프의 주기율표가 잘못되었다는 주장까지 나오게 되었다. 하지만 최종적으로는 '플루오린(F)'과 '염소(Cl)'아래에 기체 원소를 넣기 위한 새로운 행을 추가하면서 주기율표에 넣을 수 있었다. 이렇게 함으로써, 멘델레예프의 주기율표의 기본을 바꿀 필요가 없어졌다. 그 뒤에도 새로운 원소가 발견될 때마다 논의가 이루어졌고, 결국은 주기율표에 맞추어 왔다.
4-4. 멘델레예프의 주기율표 외에도 주기율표의 시도가 있었다.
독일의 '요한 되베라이너(1780~1849)'는 1829년에 갓 발견된 '브로민(Br)'의 반응성이 '염소(Cl)', '요오드(I)'와 비슷하다는 사실을 알아차렸다. 또 '칼슘(K)', '스트론튬(Sr)', '바륨(Ba)'의 세 가지가, 그리고 '황(S)', '셀레늄(Se)', '텔루륨(Te)'의 세 가지가 비슷하다는 것을 발견했다. 되베라이너는 이들을 '3조 원소'라고 이름 붙였다. 이는 최초의 원소 그룹 나누기였던 것으로 보인다.
1862년, 프랑스의 광물학자 '알렉상드르에밀 베기에 드샹쿠르투아(Alexandre-Émile Béguyer de Chancourtois, 1820~1886)'는 '땅의 나선'을 발표했다. 원소를 나선 위에 나열하면, 성질이 비슷한 원소가 수직으로 나열된다는 것이다. 그러나 '수비학(numerology)'을 근거로 설명해서 어려웠고, 원기둥의 그림도 생략되었기 때문에 대부분의 사람이 이해할 수 없었다.
영국의 화학자 '존 알렉산더 레이나 뉴랜즈(John Alexander Reina Newlands, 1837~1898)'도 1864년에 독자적인 법칙을 발견했다. 최초의 원소에서 8번째의 원소가 최초의 원소와 비슷하다는 '옥타브의 법칙(Law of Octaves)'을 발표했으나, 원자량이 큰 원소에는 들어맞지 않아 인정되지 않았다.
반응형5. 최신 주기율표
멘델레예프가 '주기율표(Periodic Table)'를 발표한 당시, 발견된 원소는 63종뿐이었다. 하지만 이후 과학적인 기술의 발전에 따라, 분리하기 어려웠던 원소도 발견할 수 있게 되었다. 2021년 현재, 인류가 발견한 원소는 118종에 이르렀으며, 현재의 주기율표는 '원자량(원자의 질량)'이 아니라 '원자 번호'순으로 되어 있다. 원자 번호는 원자 중심부에 존재하는 '양성자(Proton)'의 수와 같다.
주기율표는 과학의 진보와 더불어 조금씩 모양을 바꾸면서도, 크게 고치는 일 없이 2배에 가까운 원소를 흡수해 왔다. 그리고 현재도 최첨단의 원소 연구를 반영하면서 화학의 '가이드 맵(Guide Map)'으로서의 중요한 역할을 다하고 있다.
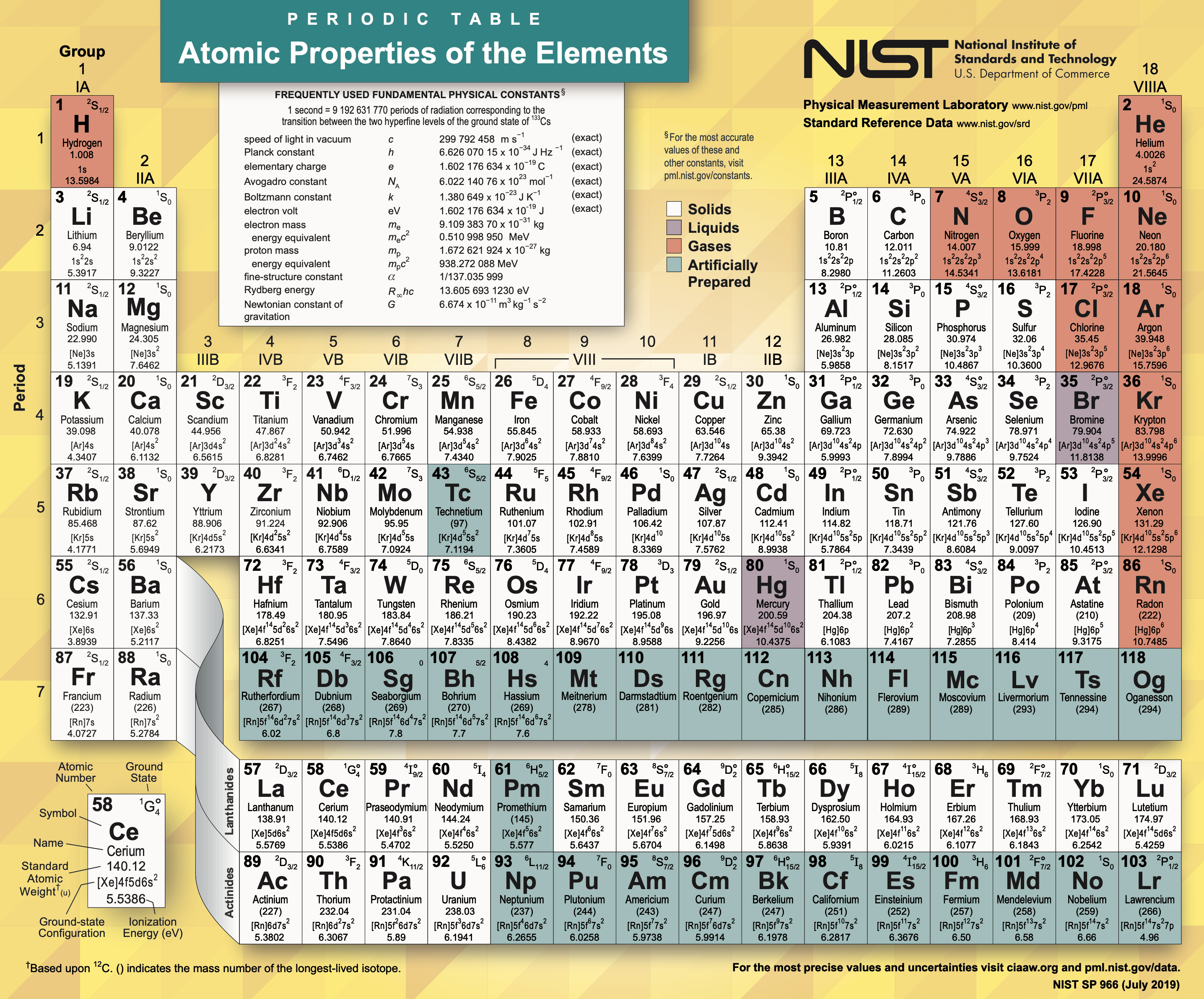
주기율표 (NIST Version 14 July 2019) 5-1. 인공적으로 합성함으로써 원소를 발견하다.
나아가 인류는 기존 원소끼리 융합시키는 등의 방법으로 무거운 원소를 인공적으로 합성할 수 있게 되었다. '우라늄(U, 원자번호 92번)'보다 무거운 원소는 기본적으로 인공적으로 합성하여 발견된 원소들이다.
'니호늄(Nh, 원자번호 113번)', '모스코븀(Mc, 원자번호 115번)', '테네신(Ts, 원자번호 117번)', 오가네손(Og, 원자번호 118번)'의 4개 원소는 2015년 말에 그 존재가 인정된 것으로, 2016년 11월에 '국제순수·응용화학연합(IUPAC, International Union of Pure and Applied Chemistry)'에서 정식 명칭을 부여하였다.
5-2. 각각의 원소가 발견된 시기
발견된 연대 발견된 원소 예로부터 알려짐 금, 은, 구리, 수은, 탄소, 주석, 납, 황, 철, 안티모니, 백금 (총 11 원소) ~1800년 비소, 인, 코발트, 아연, 니켈, 비스무트, 수소, 산소, 질소, 염소, 망간, 몰리브데넘, 텅스텐, 텔루륨, 스트론튬, 지르코늄, 우라늄, 티타늄, 이트륨, 크롬 (총 20 원소) 1801~1850년 탄탈럼, 로듐, 팔라듐, 세륨, 오스뮴, 이리듐, 나트륨, 알루미늄, 칼륨, 칼슘 바륨, 아이오딘, 리튬, 셀레늄, 카드뮴, 규소, 브로민, 베릴륨, 마그네슘, 루테늄, 토륨, 바나듐, 란타넘, 터븀, 어븀, 나이오븀 (총 26 원소) 1851~1900년 세슘, 루비듐, 탈륨, 인듐, 헬륨, 갈륨, 이터븀, 스칸듐, 사마륨, 홀뮴, 툴륨, 가돌리늄, 프라세오디뮴, 네오디뮴, 플루오린, 저마늄, 디스프로슘, 붕소, 아르곤, 유로품, 네온, 크립톤, 제논, 플로늄, 라듐, 악티늄, 라돈, (총 27 원소) 1901~1950년 루테튬, 프로트악티늄, 하프늄, 레늄, 테크네튬, 프랑슘, 아스타틴, 넵투늄, 플루토늄, 퀴륨, 아메리슘, 프로메튬, 버클륨, 캘리포늄 (총 14 원소) 1951~2000년 아인슈타이늄, 페르뮴, 멘델레븀, 노벨륨, 로렌슘, 러더포듐, 더브늄, 시보귬, 보륨, 마이트너륨, 하슘, 다름슈타튬, 뢴트게늄, 코페르니슘, 프레로븀, 리버모륨 (총 16 원소) 2001년~ 나호늄, 모스코븀, 테네신, 오가네손 (총 4 원소) 5-3. 여러 모양의 주기율표
지금까지 살펴본 주기율표는 학교 수업에서도 볼 수 있는 가장 흔하고 친숙한 것이었다. 하지만 이런 일반적인 주기율표 외에도, 실로 독특한 주기율표들도 고안되고 있다. 예컨대, 지금까지 살펴본 주기율표에는 1족과 18족, 3주기의 마그네슘과 알루미늄 사이에 틈이 있다. 이들 원소 사이는 원래 연결되어 있어야 하는 것이라고 보아, 이들을 연결한 두루마리 모양의 주기율표가 고안되어 있다. 입체적인 주기율표도 있다. 같은 주기의 원소를 같은 판 위에 늘어세우면서 쌓아 올린다. 위에서 내려다보면 같은 족 원소가 위에서 아래로 관통되는 것처럼 보이는 주기율표이다. 이외에도 앞으로 여러 가지 방법으로 원소를 배열한 주기율표가 등장할 것이다. 또 새로운 원소의 발견도 기대된다.


여러 가지 모양의 주기율표 반응형6. 동위 원소(isotope)
6-1. 동위 원소를 발견하다.
원자는 '양성자(Proton)'와 '중성자(Neutron)', '전자(Electron)' 등 3가지 부품으로 이루어져 있다. 이것은 모든 원자에서 공통이며 이 부품의 수에 따라 원자의 성질이 달라진다. 그러면 이 부품들의 질량은 어떨까? 양성자의 질량이 1이라고 했을 때, 양성자와 중성자의 질량은 거의 같고, 전자의 질량은 이들의 약 1836분의 1밖에 되지 않는다. 따라서 원자의 질량은 거의 원자핵의 질량이라고 할 수 있다. 하지만 실제로 측정해 보면, 원자의 원자량은 정수로 딱 떨어져 나오지 않는다. 예컨대, '네온(Ne, 원자번호 10번)'의 원자량은 '20.18'이라는 어중간한 값으로 측정된다. 전자의 질량을 더해봐도 오차가 생긴다.
이 어중간한 원자량에 대한 수수께끼를 푼 사람은 영국의 화학자 '프레더릭 소디(Frederick Soddy, 1877~1956)'었다. 그는 '우라늄(U)'의 원자핵이 불안정해져 붕괴하면 여러 가지 다른 원소가 생기는 현상인 '방사성 붕괴'를 발견한 사람이다. 그는 연구를 계속하다가, 우라늄의 붕괴로 생긴 새로운 원소로 보이는 원소를 발견했다. 하지만 이 원소는 이미 알려져 있는 원소와 질량이 다른데도 성질은 거의 같았다. 1912년, 소디는 같은 원소라도 서로 다른 질량을 가진 원자가 있다고 발표하였고, 이런 원자를 '동위 원소(isotope)'라고 명명했다.
6-3. 원자량이 어중간한 값을 갖는 이유는 '동위 원소' 때문
1930년대가 되자 원자핵은 '양성자(Proton)'와 '중성자(Neutron)'로 이루어져 있음이 알려졌다. 그리고 또 '동위 원소'의 질량 차이는 중성자 수의 차이에서 유래된다는 사실도 알려졌다.
그러면 네온의 원자량이 20.18라는 결과는 어떻게 나온 것일까? '동위 원소'라는 것이 있다. '동위 원소(isotope)'는 양성자의 수는 갖지만, 중성자의 수는 다른 원소를 말한다. 예컨대, 네온의 안정 동위 원소는 '20Ne'와 '21Ne'와 '22Ne' 3가지가 있다. 사실 네온의 동위 원소는 이 3가지 외에도 더 많지만, 천연으로 존재하는 네온의 동위 원소는 이 3가지다. '천연 존재비'를 반영한 뒤, 네온의 원자량을 측정하면 네온의 원자량인 '20.18'이 나온다.
동위 원소 질량수 양성자와 중성자 수 천연 존재비 20Ne 20 양성자 10개, 중성자 10개 90.48% 21Ne 21 양성자 10개, 중성자 11개 0.27% 22Ne 22 양성자 10개, 중성자 12개 9.25% 
네온의 원자량 계산 7. 전자껍질(Electron Shell)
양성자는 +1의 전기를, 전자는 -1의 전기를 띠고 있다. 그래서 예컨대, 산소 원자가 '8개의 양성자'가 '+8의 전기'를 띠고 있으면, 주위에는 그것과 균형을 맞추도록 '8개의 전자'가 '-8의 전기'를 띠며 날아다니고 있다. 이렇게 균형을 맞추어 양성자와 전자의 수가 같아지면 전기의 값은 0이 되어, 원자 전체로는 전기를 띠지 않게 된다.
7-1. 전자의 '정원(최대 수)'
그런데 1913년, 덴마크의 물리학자 '닐스 보어(Niels Bohr, 1885~1962)'는 원자 안에서 전자가 존재하는 영역에 일정한 규칙이 있음을 밝혀냈다. 보어에 의하면, 전자는 원자핵 주위를 마음대로 도는 것이 아니라, 전자가 존재는 영역은 층층의 공으로 나누어져 있다고 한다. 예컨대 8개의 전자를 가진 '산소(O, 원자 번호 8)'의 경우, 원자핵에서 가장 가까운 층에 2개의 전자가 있고, 그 바깥쪽 층에 6개의 전자가 있다.
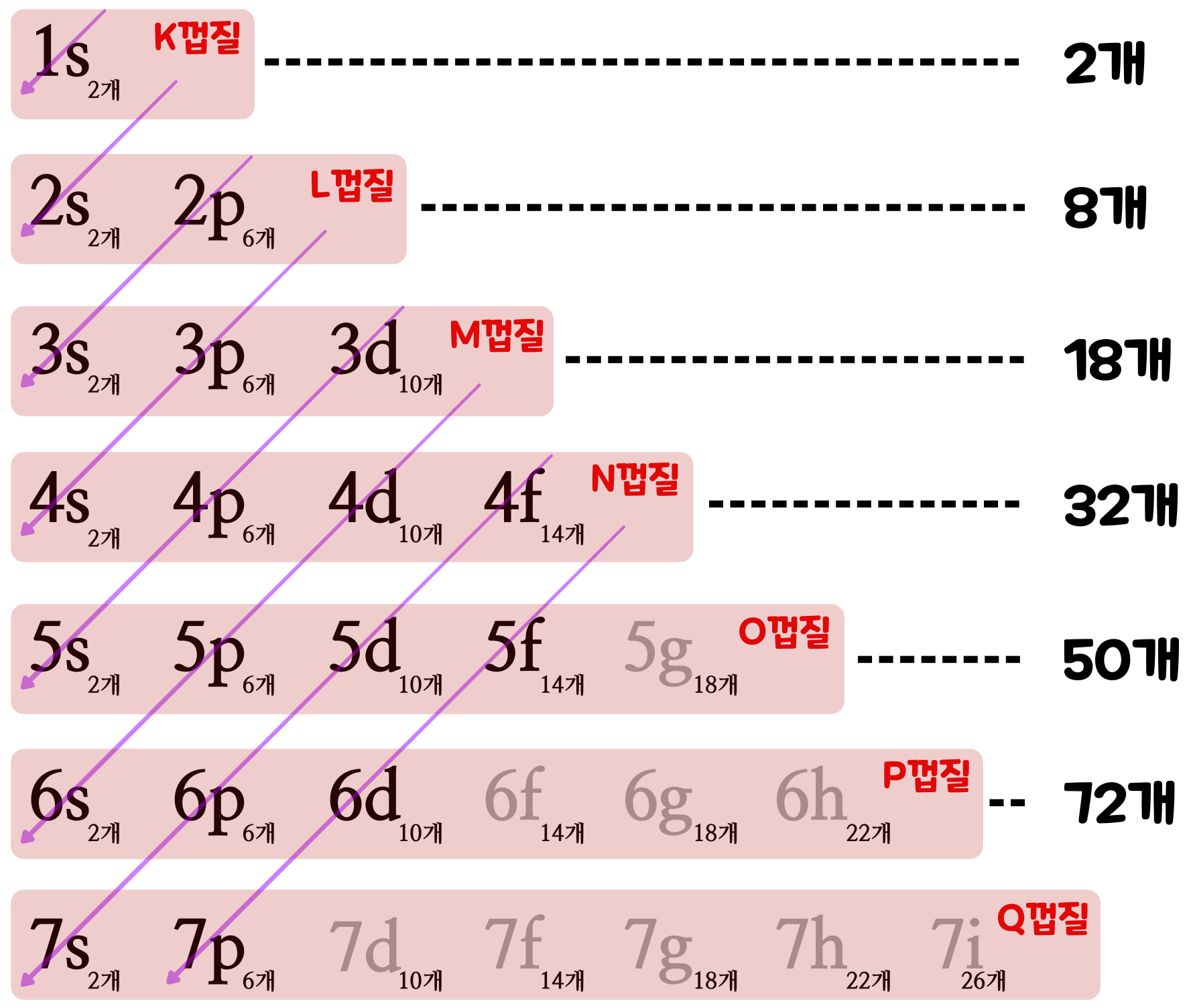
전자가 존재하는 층 모양의 껍질은 '전자껍질(Electron Shell)'이라고 부른다. 그리고 원자핵에서 가까운 쪽부터 K 껍질, L 껍질, M 껍질, N 껍질, O 껍질, P 껍질... 등의 이름이 붙어 있다. 바깥쪽에 있는 '전자껍질'일수록, 하나의 껍질 속에 존재할 수 있는 전자의 '정원(최대 수)'이 많아진다. K 껍질에는 최대 2개, L 껍질에는 최대 8개, M 껍질에는 최대 18개, N 껍질에는 최대 32개, O 껍질에는 최대 50개, P 껍질에는 최대 72개, Q 껍질에는 최대 92개까지 전자를 채울 수 있다.
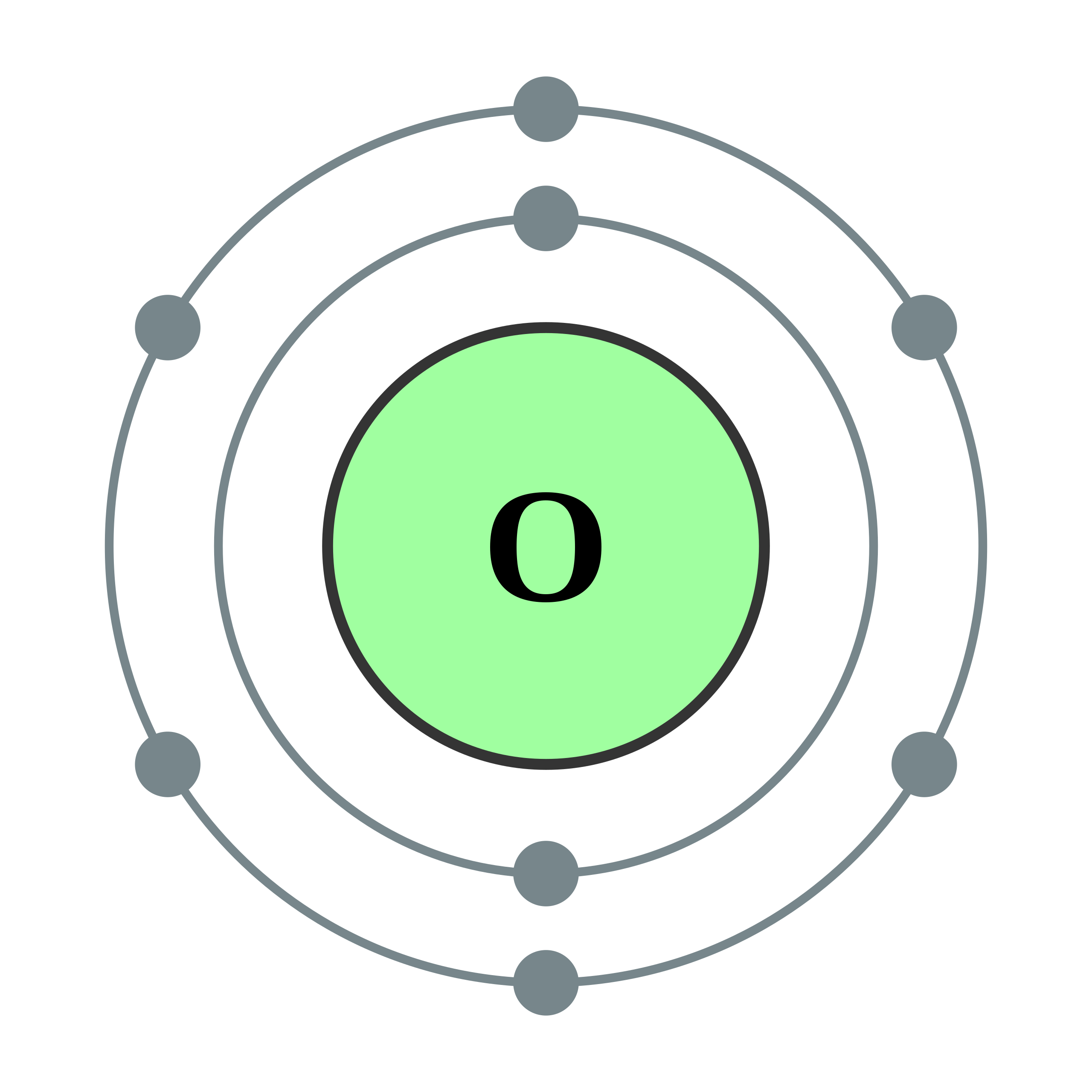
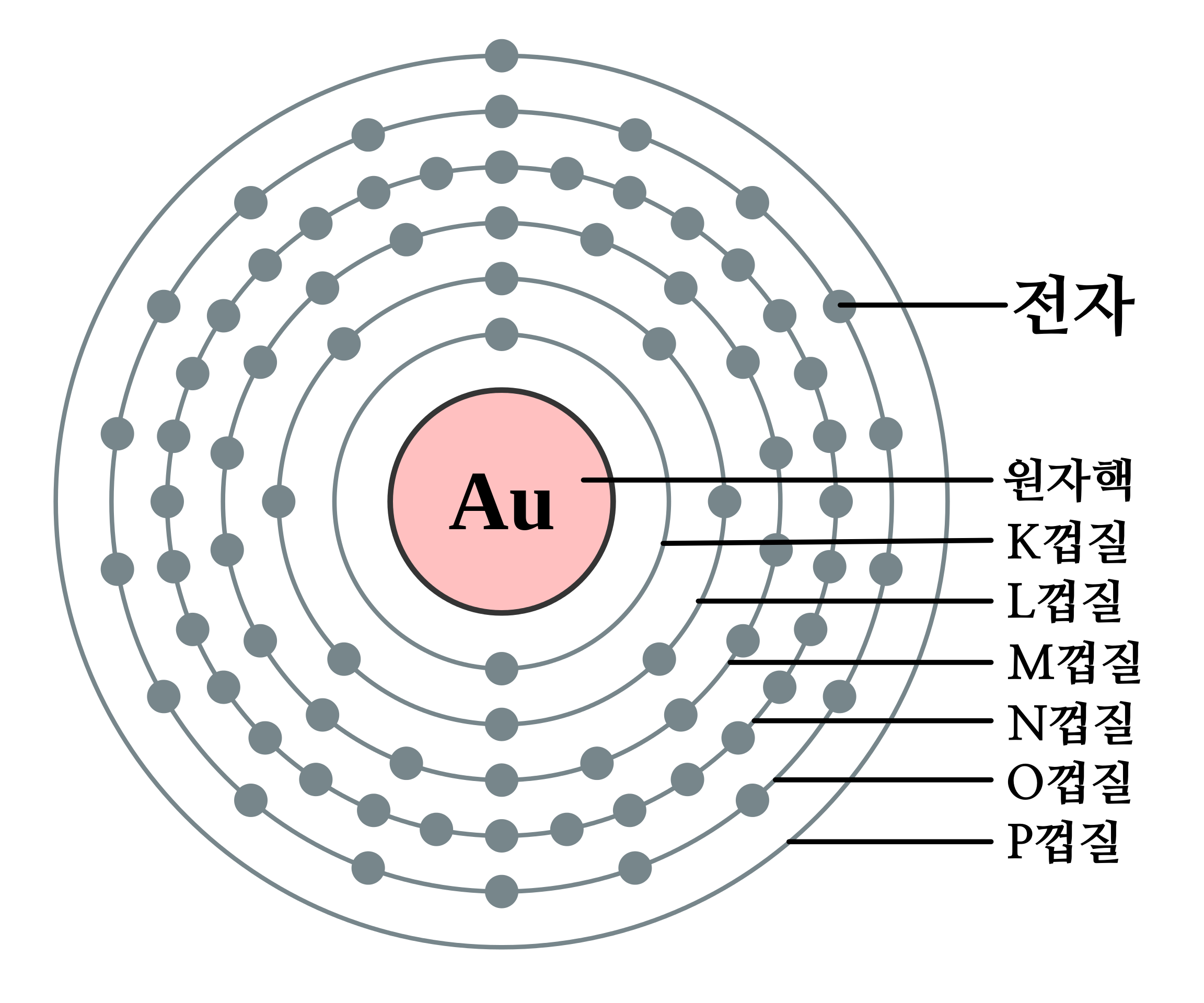
산소(O, 원자번호 8) (좌), 금(Au, 원자번호 79) (우) 7-2. 전자 부껍질
전자껍질은 다시 몇 개의 '전자 부껍질'로 나누어져 있으며, 전자 부껍질의 수는 전자껍질이 원자핵에서 멀어질 때마다 하나씩 늘어난다. '전자 부껍질'에는 '1s 궤도'나 '2s 궤도'등의 이름이 붙어 있고, 각 전자 부껍질에 전자가 존재할 수 있는 최대의 수는 정해져 있다. n 번째 전자껍질에 들어갈 수 있는 전자의 '정원(최대 수)'는 2×n²개이다.
전자껍질 전자 부껍질과 전자의 최대 수 합계 K 껍질 1s 궤도: 2 2 L 껍질 2s 궤도: 2
2p 궤도: 68 M 껍질 3s 궤도: 2
2p 궤도: 6
3d 궤도: 1018 N 껍질 4s 궤도: 2
4p 궤도: 6
4d 궤도: 10
4f 궤도: 1432 O 껍질 5s 궤도: 2
5p 궤도: 6
5d 궤도: 10
5f 궤도: 14
5g 궤도: 1850 P 껍질 6s 궤도: 2
6p 궤도: 6
6d 궤도: 10
6f 궤도: 14
6g 궤도: 18
6h 궤도: 2272 Q 껍질 7s 궤도: 2
7p 궤도: 6
7d 궤도: 10
7f 궤도: 14
7g 궤도: 18
7h 궤도: 22
7i 궤도: 2698 주기율표에서 주기(가로줄)은 '전자가 어떤 전자껍질까지 존재하는가?' 즉, '가장 바깥쪽 전자껍질이 무엇인가?'를 말해준다. 제1주기는 K 껍질까지만 존재하고, 2주기는 L 껍질까지, 3주기는 M 껍질까지, 4주기는 N 껍질까지 전자가 존재하는 원소라는 식이다. K 껍질은 전자의 최대 수가 2개이기 때문에 1주기의 원소의 수는 2개가 되고, L 껍질은 전자의 최대 수가 8개이기 때문에 2주기의 원소의 수는 8개가 된다.
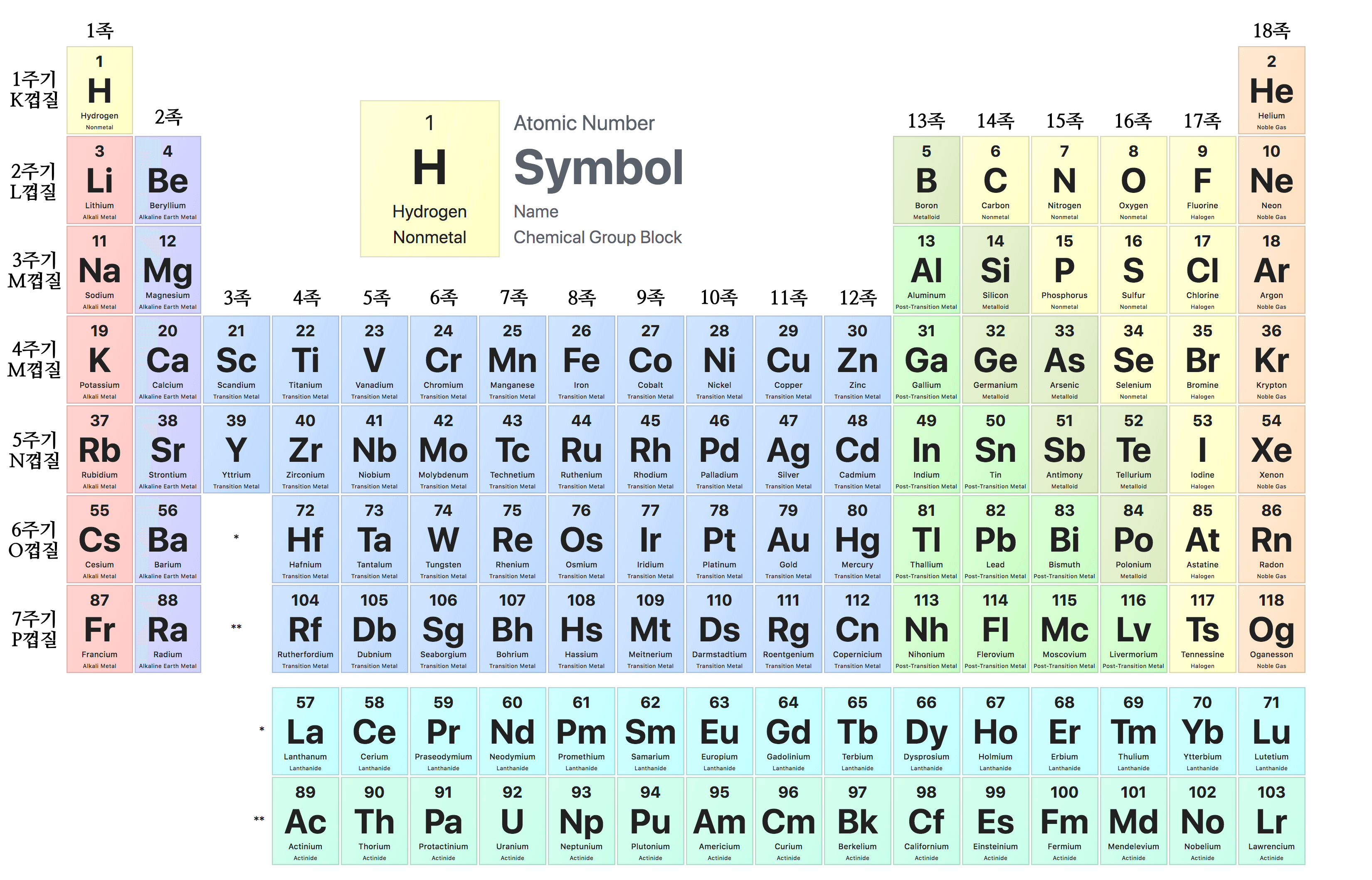
주기율표 7-3. 전자가 들어가는 순서
음전기를 띤 전자는 양전기를 띤 원자핵에 끌려, 원자핵에서 가까운 전자 부껍질부터 먼저 들어간다. 기본적으로 전자 부껍질에 전자가 가득 차면, 그다음으로 원자핵에 가까운 전자 부껍질로 전자가 들어가기 시작한다.
원자핵에서 먼 전자껍질일수록 많은 전자 부껍질을 갖기 때문에 전자껍질에 존재할 수 있는 전자의 총수도 많아진다. 그리고 전자 부껍질은 각각 원자핵까지의 '가까운 정도'가 서로 다르다. 원자핵으로부터 가장 가까운 '전자 부껍질'을 순서대로 배열하면, 아래에 있는 그림처럼 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p 7s, 5f, 6d, 7p... 와 같은 순서이다. 예컨대, M 껍질에 있는 4s 전자 부껍질은, M 껍질에 있는 3d 전자 부껍질보다 원자핵에 가깝다.
'M 껍질(3번째 전자껍질)'에 들어가는 전자의 최대의 수는 18개인데, 제3주기에는 원소가 8개밖에 없다. 이것은 전자가 M 껍질에 들어갈 '빈 공간'을 남기고, N 껍질에 들어가기 시작하기 때문이다. 아래의 그림에서는 제4주기에서 최초의 원소인 '칼륨(K, 원자번호 19번)'의 전자 배치를 전자껍질 그림으로 나타냈다. N 껍질의 4s 궤도는 M 껍질의 3p 궤도보다는 원자핵에서 멀지만 M 껍질의 3d 궤도보다는 원자핵에서 가깝기 때문에, 3p 궤도에 전자가 가득차면 3d 궤도가 아닌 4s 궤도부터 전자가 차기 시작한다. 4s 궤도에 전자가 가득차고 나서야 3d 궤도에 전자가 들어가기 시작한다. 이러한 이유 때문에, 제4주기의 원소 수는 제3주기보다 많아진다.
원자핵에서 가까운 '전자 부껍질'의 순서 7-4. 실제의 전자는 '어렴풋이' 존재한다.
위의 그림에서 전자가 원자 속에서 전자껍질에 대응하는 영역에 나뉘어 존재한다고 설명했다. 하지만 실제로는 전자껍질의 층이 있다고 해도, 알갱이 모양의 전자가 돌고 있는 것은 아니다. '양자역학'에 의하면 실제의 전자는 확실한 경계가 있는 영역을 움직이는 것이 아니며, 알갱이 모양을 하고 있는 것도 아니다. 전자는 특정 영역에 흐릿하게 구름처럼 퍼져 있다고 생각된다.
양자 역학에 의하면, 전자는 '전자 궤도(Electron Orbit)'라는 영역에 나뉘어 존재한다. 전자 궤도에는 몇 가지 형태가 있는데, s 궤도, p 궤도, d 궤도 등의 이름이 붙어 있다. 그리고 여러 궤도가 서로 겹쳐, 원자 전체로는 커다란 공 모양의 구름처럼 되어 있다. '전자 궤도'는 위에서 설명한 '전자 부껍질'에 해당한다.
반응형8. 같은 족의 원소가 비슷한 성질을 나타내는 이유
주기율표에서 같은 족의 원소는 기본적으로 가장 바깥쪽 껍질의 전자 수가 같은데, '원자가전자(바깥쪽의 전자 수)'에 따라 성질이 달라진다. 이 사실은 미국의 화학자 '길버트 루이스(Gilbert Lewi, 1875~1946)'가 1902년에 최초로 알아냈다. 예컨대 1족 원소는 원자가전자의 수가 1개이다. 이 때문에 이 전자를 내놓고 +1의 양이온이 된다. 마찬가지로 2족 원소는 최외각에 있는 2개의 전자를 내놓고 +2의 양이온이 된다. 한편, 염소 원자가 속한 17족 원소는 최외각에 전자를 1개를 얻어 -1의 음이온이 된다. 16족 원소는 전자 2개를 얻어 -2의 음이온, 15족 원소는 전자 3개를 얻어 -3의 음이온이 된다. 18족 원소는 대부분 이온이 되지 않는다.
8-1. 1족 (알칼리 금속 원소)
'수소(H)'를 제외한 1족의 원소를 '알칼리 금속 원소'라고 하는데, 알칼리 금속끼리는 비슷한 성질이 있다. 나트륨 말고도 '알칼리 금속 원소'는 물과 접하면 같은 반응을 일으킨다. 즉 '알칼리 금속 원소'는 안정되기 위해, 가장 바깥쪽 껍질에 있는 1개의 전자를 방출할 수밖에 없는 원소들이다.
'알칼리 금속(리튬, 나트륨, 칼륨 등)'에 속한 금속은 연하고 가벼운 특성이 있다. '리튬(Li)'이나 '나트륨(Na)'의 경우, 금속인데도 칼로 자를 수 있을 정도이다. 또 '알칼리 금속'의 큰 특징의 하나는 반응성이 매우 높다는 점이다. 반응성이 높아서, 예컨대 물과도 폭발적으로 반응한다. 물과 반응한다는 사실을 별로 위험하지 않게 느끼는 사람이 있을지도 모르겠지만, 공기 중의 수분과도 반응하기 때문에 취급할 때 매우 주의해야 한다. 보존할 때도 그대로 시약벽에 넣을 수 없다. 리튬, 나트륨, 칼륨은 석유 안에 넣어 보존한다. 또 '루비듐(Rb)'과 '세슘(Cs)'는 반응성이 높기 때문에 '밀봉 용기'에 보관한다. 특히 '세슘'의 반응성은 알칼리 금속 속에서 최대여서, 상온의 공기 중에서도 즉시 반응하며 물과도 폭발적으로 반응한다. 그러면 알칼리 금속은 왜 이렇게 반응성이 높을까?
'나트륨(Na)'을 예로 그 이유를 알아보자. '알칼리 금속 원소'인 '나트륨(Na)'은 물을 머금은 여과지 위에 두면, 나트륨과 물이 화학 반응을 일으켜 열과 수소를 발생시키는 '불꽃반응(Flame reaction)'이 일어난다. 이 반응이 일어나는 이유는 나트륨 원자가 가장 바깥쪽 껍질에 있는 1개의 전자를 쉽게 물 분자에게 넘겨 버리기 때문이다. 나트륨 원자가 가장 바깥쪽 껍질인 'M 껍질'에 있는 1개의 전자를 방출하면, M 껍질이 없어지고 하나 안쪽의 L 껍질이 가장 바깥쪽 껍질이 된다. 정원이 꽉 찰 때까지 전자가 들어간 전자 부껍질은 정원에 빈자리가 있는 상태에 비해 안정된다. 즉, 나트륨 원자는 전자를 1개 방출하여 전자의 정원을 채운 '안정된 상태'가 된 것이다.
8-2. 18족 (비활성 기체 원소)
비활성 기체 원소의 가장 바깥쪽 껍질에는 s 궤도와 p 궤도라는 두 '전자 부껍질'에 전자가 정원을 가득 채운다. (헬륨은 s 궤도뿐임.) 즉, 처음부터 안정된 상태이므로 안정되기 위해 전자를 방출하거나 받아들일 필요가 없다. 그래서 '비활성 기체(Noble gas)' 원소는 다른 물질과 거의 반응하지 않는다. 비활성 기체는 금속이 녹을 정도의 고온에서도 잘 반응하지 않는다.
반응을 잘 하지 않은 비활성 기체의 성질은 여러 분야에 사용되고 있다. 공기보다 가벼운 '헬륨(He)'은 불을 가까이해도 타는일이 없기 때문에, 비행선이나 기구 등에 사용된다. 또 헬륨은 목소리를 바꾸는 '변성 가스'로도 사용한다. 목소리는 성대의 떨림이 공기를 진동시킴으로써 소리로 들린다. 그런데 성대 부근이 변성 가스로 가득 차면, 성대의 진동을 받았을 때 공기만의 진동과는 다른 진동으로 파동으로 전해지기 때문에, 목소리가 달라진 것처럼 들린다.
사람이 깊은 바다에 잠수해 높은 압력을 받으면, 보통 때는 영향을 미치지 않는 질소도 혈액에 녹아 나중에 '잠수병'이나 '케이슨병' 같은 나쁜 영향을 미치게 된다. 수심 10m 이상 잠수하는 경우 고압이므로 질소가 핏속에 녹아 들어간다. 하지만 '헬륨(He)'이나 '아르곤(Ar)'은 몸속에 들어가도 다른 물질과 결합해 해를 입히는 일이 없기 때문에, 심해 잠수용 펌프에는 '헬륨(He)'이나 '아르곤(Ar)'이 섞여 있다.
8-3. 3~11족 (전이 원소)
일반적으로 전자는 원자의 안쪽에 있는 전자 껍질로부터 채워 나간다. 그래서 원자 번호가 순서대로 늘어나면, 가장 바깥쪽 전자 껍질의 수가 늘어난다. 그러나 원자 번호가 늘고 전자의 수가 늘어나는데도, 가장 바깥쪽 전자의 수가 바뀌지 않은 원자들이 있다. 실제로 안쪽의 접자 껍질이 채워지지 않았는데, 바깥쪽 껍질에 전자가 들어가는 일이 있다. 그래서 원자 번호가 달라지고 전자의 수도 다른데, 가장 바깥쪽 껍질에 있는 전자가 1~2갤 거의 변하지 않게 된다. 이런 원소는 3~11족에 자리하고 있으며, 이 원소들을 '전이 원소(transition elements)'라고 한다. '전이 원소'들은 모두 전자 수가 다르지만, '원자가전자(원자에서 바깥쪽 껍질에 존재하는 전자)'의 수는 1~2개로 거의 같다. 왜 그럴까?
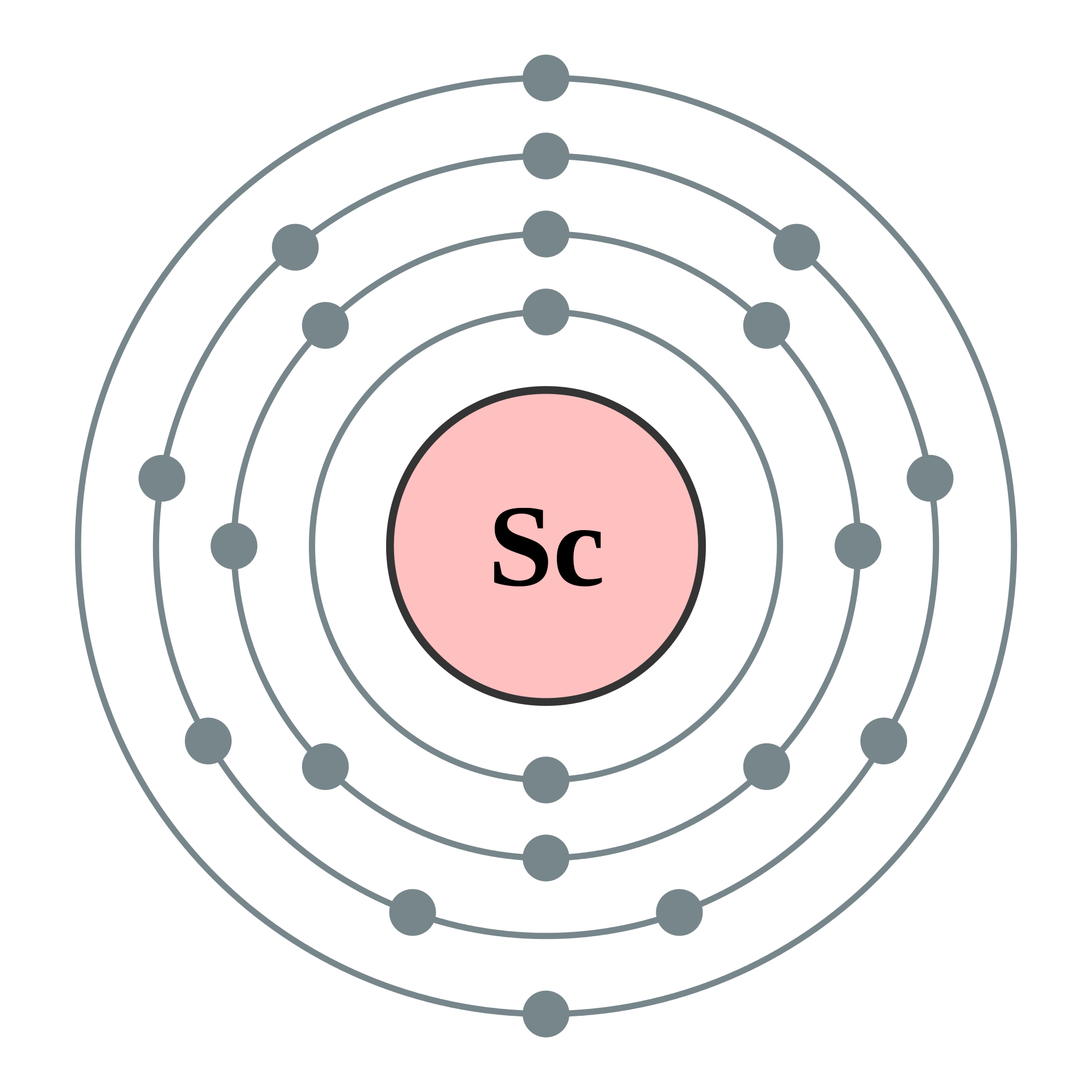
여기서 4주기의 '전이 원소'를 예로 들어보자. 전자는 안쪽부터 K, L, M, N껍질의 순으로 채워져 들어간다. 각 전자껍질은 몇 개의 '부껍질'로 나뉜다. 놀랍게도 4주기에서는 M껍질의 부껍질보다 N껍질의 부껍질에 먼저 들어간다. N껍질의 이 부껍질 정원이 가득차면, 그제야 비어 있는 M껍질의 부껍질로 전자가 들어가기 시작했다. 이때 원자가전자 수는 N껍질에 있는 1~2개가 된다. 그래서 '원자가전자(Valence Electron)' 수가 같은 '전이 원소'는 비슷한 성질이 있다.
4주기에 있는 '스칸듐(Sc, 원자번호 21번)'의 전자 배치를 생각해 보자. K껍질에는 '1s', L껍질에는 '2s' '2p', M껍질에는 '3s' '3p' '3d', N껍질에는 '4s' '4p' '4d' '4f' 등의 부껍질이 있다. 전자는 그림에서 아래에 있는 자리부터 들어간다. 그런데, M껍질의 3p 궤도가 가득 차면, M껍질의 3d 궤도가 아니라 N껍질의 4s 궤도로 전자가 먼저 들어간다. 이처럼 전자가 안쪽보다 먼저 바깥쪽 전자껍질에 들어가는 것이 '전이 원소'의 특징이다.
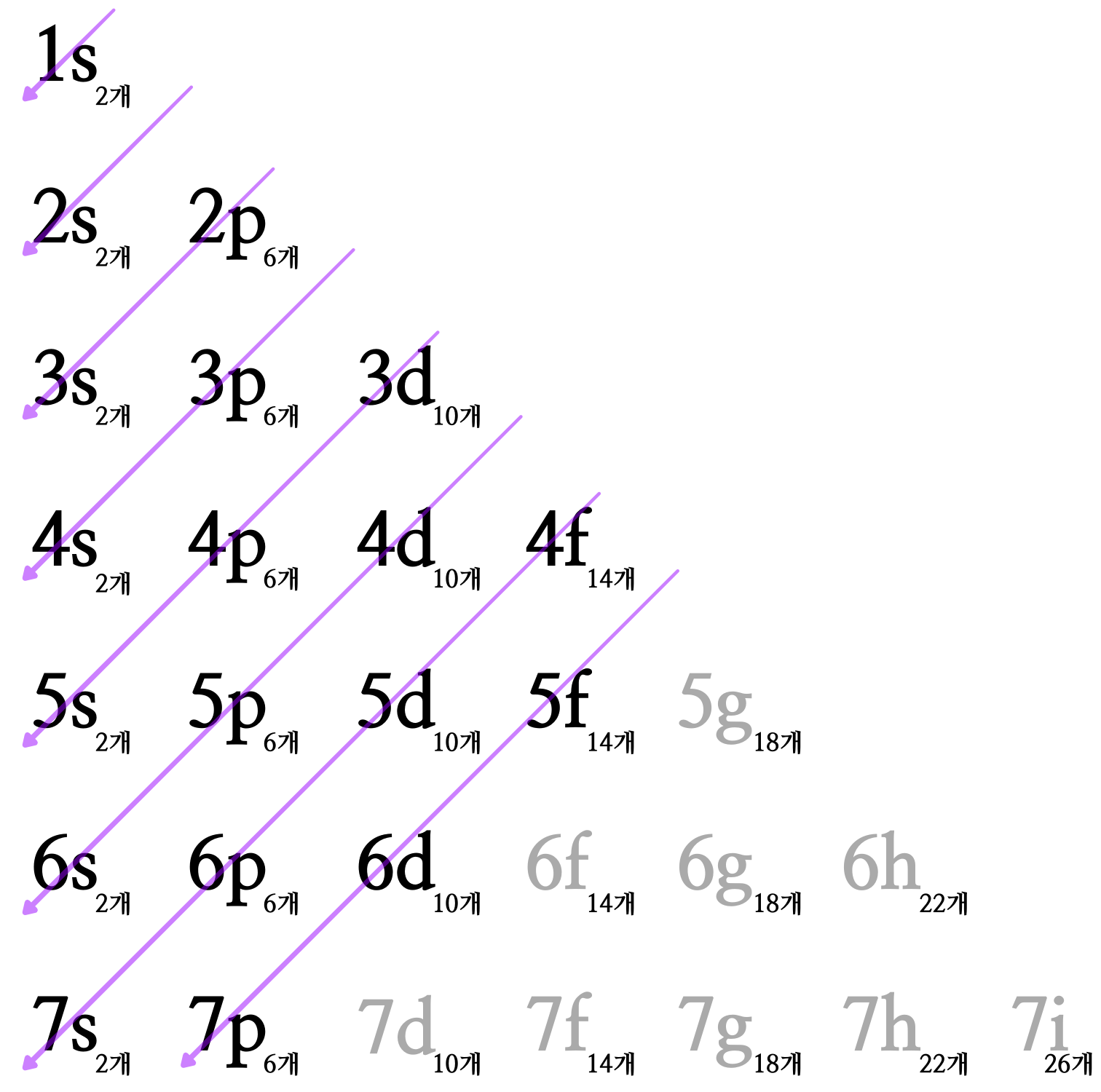
9. 원소는 몇 번까지 존재할까?
2015년 말에 113번, 115번, 117번, 118번의 원소가 공식으로 인정되면서, 주기율표가 제7주기까지 가득 차게 되었다. 하지만 주기율표는 아직 완성된 것이 아니다. 119번 이후는 미발견 원소이다.
9-1. 초중원소(Superheavy Elements)
원자 번호가 104번 이후인 원소를 '초중원소(Superheavy Elements)'라고 한다. 최초의 초중원소는 '러더포듐(Rh, 원자 번호 104번)'으로 발견·합성된 것은 1960년대의 일이었다. 그 이후 약 50년 동안 인류는 118번 원소까지 도달했다. 과학의 지평은 꾸준히 넓혀진 셈이다. 그리고 다음의 119번 원소부터는 주기율표의 '제8주기'에 들어간다. '궁극적으로 원소로 존재할 수 있는 한계가 어디일까?'라는 의문을 풀기 위해서라도, 초중원소'의 합성의 도전은 앞으로도 계속될 것이다.
그리고 새 원소의 발견만이 중요한 일은 아니다. 이미 발견된 원소라도 중성자 수가 다른 '동위 원소(isotope)'가 존재한다. 미확인 동위 원소도 많이 남아 있어, 이들에 대한 이해를 넓혀 감으로써 '초중원소'의 원자핵 합성·붕괴·분열의 메커니즘이 규명될 것이다.
'초중원소의 화학적 성질'에 대해서도 알려지지 않은 점이 많다. 그 이유는 합성할 수 있는 초중원소의 수가 적고, 또 많은 초중원소가 매우 불안정하기 때문이다. 초중원소는 원자핵의 양성자 수가 많기 때문에, 주위의 전자를 끌어당기려는 힘도 커진다. 그래서 전자가 원자핵 주위를 운동하는 속도가 빨라진다. 그러면 상대성 이론에서 예상되는 효과에 의해 전자의 무게가 무거워진다. 그 결과, 원자핵의 가까운 전자 궤도가 더욱 원자핵으로 다가가고, 원자핵에서 멀리 떨어진 전자 궤도는 더욱 원자핵에서 멀어진다. 즉, 초중원소의 전자 궤도는 일반적인 원소의 전자 궤도와 달라진다. 전자 궤도는 그 원소의 화학적인 성질을 결정하기 때문에, 초중원소의 화학적인 성질은 일반적인 원소와 크게 다를 가능성도 있다.
그러면 원소는 몇 번까지 존재할까? 이론적으로는 172번 원소도 가능하다. 그러면 172번 이후에는 어떻게 될까? 104번 이후의 원소를 '초중원소(superheavy element)'라고 한다. '초중원소(Superheavy Element)'는 기본적으로 자연계에 존재하지 않기 때문에, 인공적으로 합성할 수밖에 없다. 게다가 매우 불안정하기 때문에 1초도 지나지 않아 원자핵이 붕괴되는 것이 대부분이다. 원자핵이 커질수록 불안정성이 커지기 때문에, 몇 번까지 존재하는지는 현시점에서 확실하지 않다.
9-2. 핵도표(Nuclear Chart)
아래의 그림은 지금까지 확인되 원소의 동위원소를 정리한 '핵도표(Nuclear Chart)'이다. 가로축은 '중성자 수'고, 세로축은 '양성자 수(원자 번호)'다. 하나의 칸이 하나의 동위 원소를 나타내며, 각 원소의 동위 원소는 가로로 한 줄로 배열되어 있다. 안정도에 따라 색 구분도 되어 있다.
만약 양성자와 중성자를 같은 수만큼 포함한 원자핵이 안정적이라면, 핵도표에서 안정된 동위 원소의 분포는 45°로 쭉 뻗어나갈 것이다. 하지만 핵도표를 보면 원자 번호가 커질수록, 안정된 동위 원소의 분포가 오른쪽으로 기울어지고 있음을 알 수 있다. 이는 원자핵이 커질수록 중성자가 많은 쪽이 안정된다는 사실을 나타낸다.
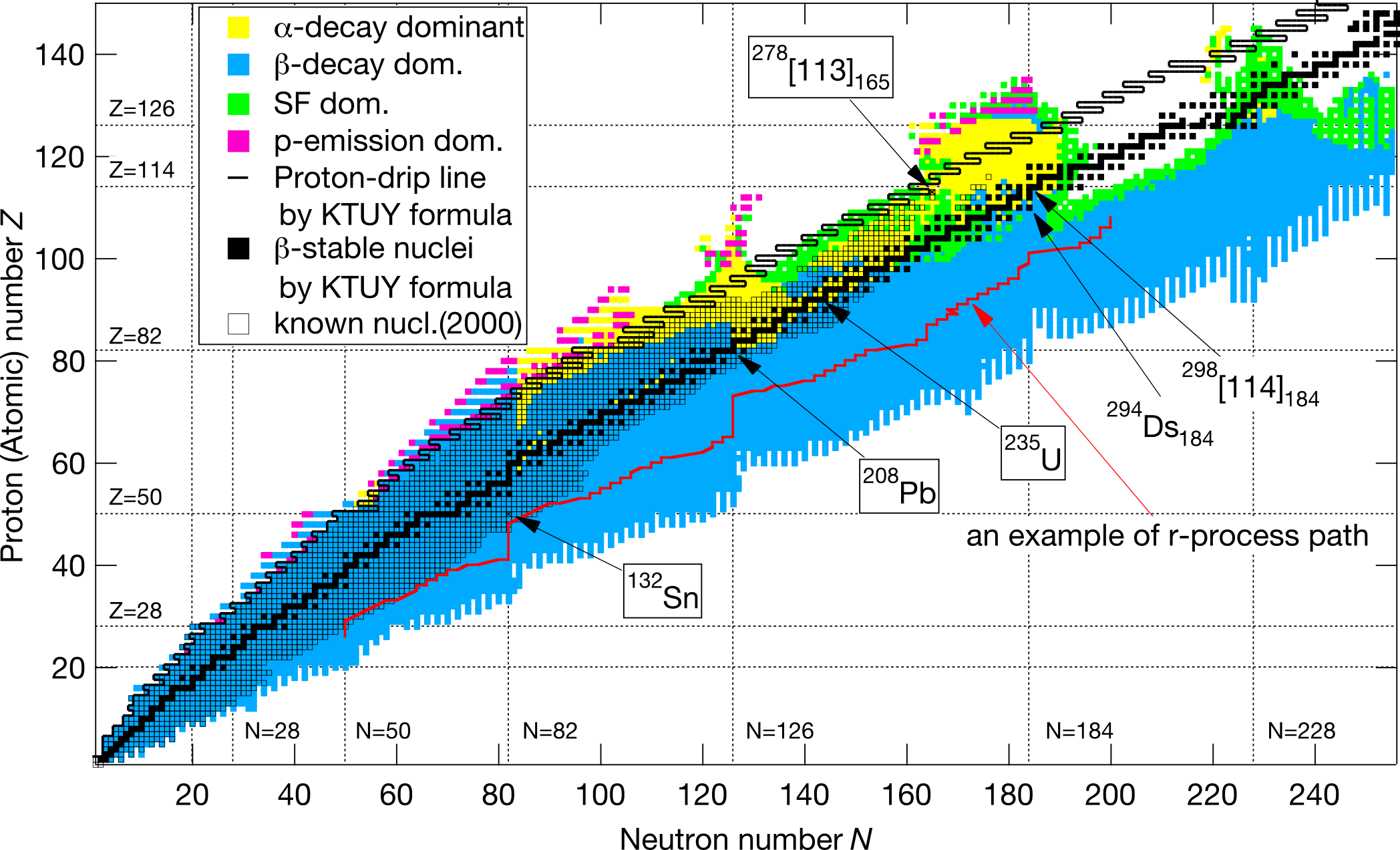
핵도표(Nuclear chart) 9-3. 마법의 수(Magic number)
원자핵은 어느 특정 양성자 수와 중성자 수일 때 특히 안정된 상태가 되는데, 원자핵이 안정되는 양성자 수 또는 중성자 수를 '마법수(Magic Number)'라고 한다. 일반적으로는 2, 8, 20 28, 50, 82가 '마법의 수'라고 알려져 있다. 이들 양성자 수와 중성자 수를 가진 동위 원소는 비교적 안정된다. 즉, 비교적 수명이 길다. 그런데 104번 이후의 초중원소는 합성할 수 있다고 해도 미미한 수의 원자밖에 만들어지지 않는 데다가, 순식간에 붕괴되는 경우가 많다. 그래서 녹는점과 끓는점 등의 성질을 조사하기가 어렵다.
그런데 실은 126은 '마법의 수(Magic number)'라고 생각된다. 즉, 126번 원소는 수명이 길 가능성이 있다. 126번 원소처럼 특별히 긴 수명의 동위 원소가 존재하는 곳을 핵도표에서는 '불안정한 바다'에 외로히 존재하는 '섬'에 빗대어 '안정성의 섬(Island of stability)'라고 부르기도 한다. 만약 126번 원소를 합성할 수 있다면, 수수께끼로 둘러싸인 초중원소의 성질을 알아낼 수 있을지도 모른다.