우리의 몸은 물을 제외하면 단백질 성분의 비율이 가장 높다. 그만큼 단백질은 생명에 중요하다. 예를 들어 음식물의 소화를 담당하는 효소도 단백질의 일종이다. 생명의 설계도인 '유전자'에는 '어떤 단백질을 만들 것인가?'라는 정보가 기록되어 있다. 사람의 경우에는 약 2만 종의 유전자에서 약 10만 종의 단백질이 만들어진다. 각각의 단백질에는 '세포의 구조 유지', '물질 수송', '정보 전달', '병원체 퇴치' 등 각각의 임무가 주어져 있다.
2017년 노벨 화학상은 '극저온 전자 현미경(Cryo-Electron Microscopy)'법의 토대를 만든 3명의 과학자, '자크 뒤보셰(Jacques Dubochet, 1942~)', '요아힘 프랑크(Joachim Frank, 1940)', '리처드 헨더슨(Richard Henderson, 1945)'에게 주어졌다. '크라이오(Cryo)'는 '극저온'이라는 의미이다. '극저온 전자 현미경법(Cryo-Electron Microscopy)'을 한 마디로 설명하면, '단백질을 -180℃ 이하의 극저온에서 급속 냉동해 얼음에 가두고, 본래의 입체 구조를 유지한 채 관찰하는 방법이다.
이 방법은 예전에는 하기 어려웠던 '막단백질(세포막에 묻혀 있는 단백질)'의 구조 해석을 비약적으로 향상시켰다. 생체에서 다양한 작용을 하는 단백질을 극저온에서 급속 냉동해 얼음에 가두는 이 방법을 사용하면, 단백질이 작동하기 위한 열쇠가 되는 '입체 구조'를 원자 차원에서 관찰할 수 있다. 그 성과를 이용하면 효과가 더욱 확실하고 부작용이 적은 약을 설계할 수 있어 앞으로의 전개가 크게 기대된다.
0. 목차
- 단백질이 작용하기 위해서는 모양이 중요하다.
- 단백질을 분석하는 3가지 방법
- 단백질의 구조 해석법 1 'X선 회절'
- 단백질의 구조 해석법 2 '핵자기 공명법'
- 단백질의 구조 해석법 3 '극저온 전자 현미경'
- 다양한 단백질 구조 분석 성과
- 신약 개발 등이 크게 발전하리라고 기대된다.

1. 단백질이 작용하기 위해서는 모양이 중요하다.
몸속에 있는 단백질은 단독으로 작용하지 않는다. 다른 조그만 분자나 단백질과 결합해 정보를 전달하거나 특정 물질만을 통과시키는 기능을 수행한다. 단백질은 서로의 모양에 딱 들어맞는 상태를 구별해 정확히 결합해야 한다. 만일 입체 구조가 아주 조금이라도 변하면 상호 작용을 할 수 없게 되거나 작용이 불충분해진다. 단백질을 '극소 기계(Micro-Machine)'이라고 생각하면, 이해하기 쉬울 것이다. 자신을 움직이는 스위치를 누르는 것은 다른 기계이다. 상대나 자신에게 이상이 생겨 스위치가 눌러지지 않으면 움직일 수 없는 것과 같다.
그렇다면 단백질의 입체 구조는 어떻게 만들어지는 것일까? 원래 단백질은 아미노산이라는 분자가 많이 연결된 물질이다. 앞에서 '유전자를 바탕으로 단백질을 만든다'고 설명했지만, 더 정확히 말하면 '유전자가 가진 정보가 단백질을 구성하는 아미노산의 나열 방식을 결정한다'이다. 생물은 20종의 아미노산을 이용하는데, 아미노산이 10개 이상 연결되면 '폴리펩티드(Polypeptide)'라고 부르며, 수십 개 이상이 연결되면 '단백질(Protein)'이라고 부른다.
하지만 단지 아미노산이 연결된 것만으로는 역할을 수행할 수 없다. 정확하게 접혀서 올바른 입체 구조를 만들어야 한다. 원래 아미노산 배열에는 서로 끌어당기거나 반발하는 부분이 많이 있어서 스스로 접힌다. 그리고 곳곳에 '당(Sugar)' 등의 다른 조그만 분자가 붙으면 완성된 단백질이 된다.
만일 유전자에 상처가 있어 아미노산 배열에 이상이 생기면, 만들어지는 단백질의 입체 구조도 변해 본래의 역할을 담당할 수 없는 경우가 있다. 유전자 이상의 정도가 가벼운 경우에는 대부분 혈압이 높거나, 알코올에 약하거나, 혈중 콜레스테롤 값이 높은 등의 체질적 문제에 그친다. 그러나 유전자 이상의 정도가 심각한 경우에는 유전자 질환 등을 일으키게 된다. 또 단백질은 열, 압력, 건조, 산이나 알칼리 등에도 약해서, 급기야 모양이 변해 작용할 수 없게 된다. 단백질의 경우 입체 구조가 모든 것을 좌우한다고 해도 지나친 말이 아니다.
2. 단백질 구조를 분석하는 3가지 방법
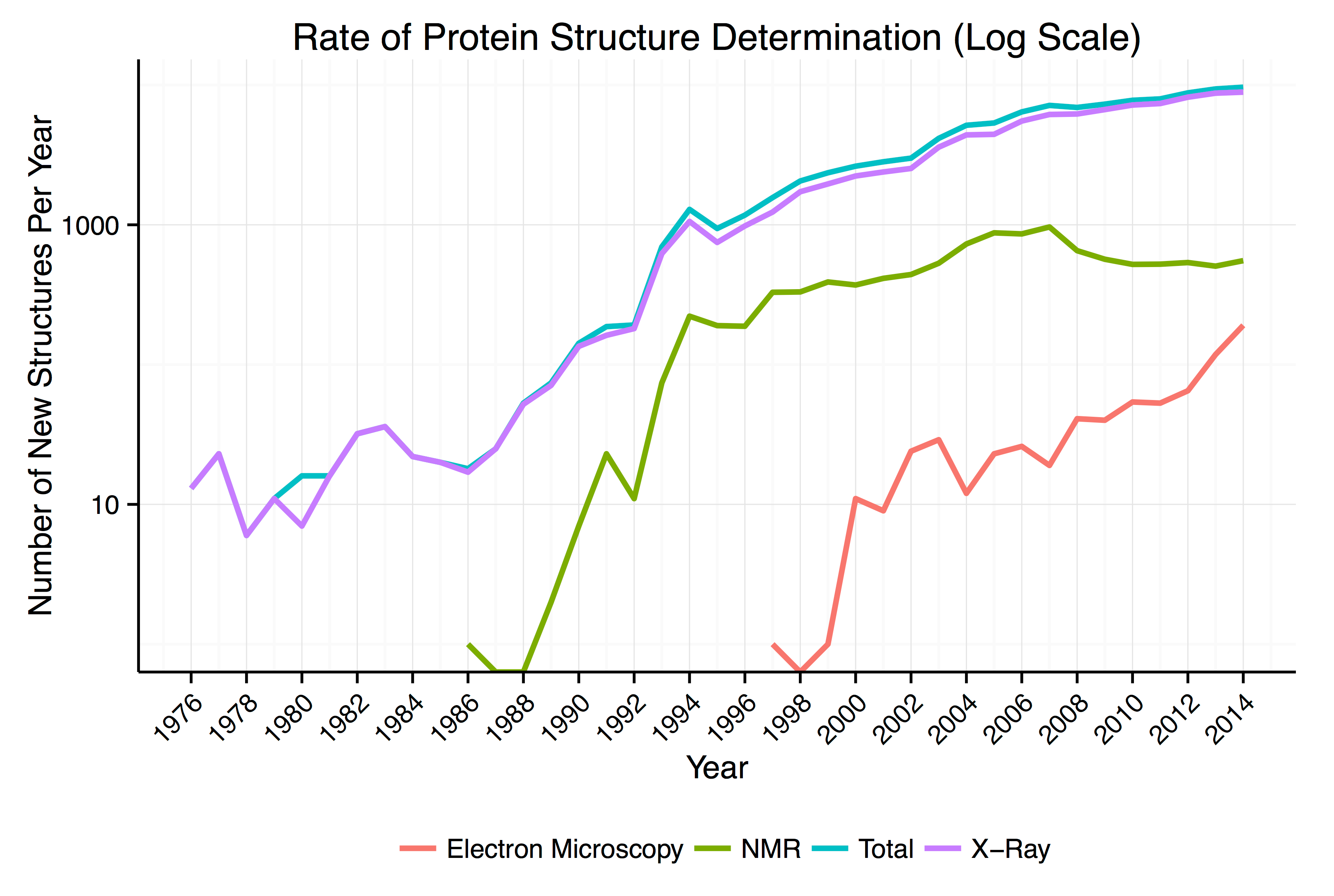
단백질 구조를 분석하는 방법에는 'X선 회절(X-ray diffraction)', '핵자기 공명(NMR: Nuclear Magnetic Resonanace)', '극저온 전자 현미경(Cryo-Electron Microscopy)'의 세 가지 방법이 있다.
- X선 회절(X-ray diffraction): 'X선 회절'을 이용하는 방법은 단백질의 구조를 분석하는 중심적인 방법이다. 결정화에는 대량의 단백질이 필요하며, 결정화할 수 없는 것은 관찰할 수 없다.
- 핵자기 공명(NMR: Nuclear Magnetic Resonanace): '핵자기 공명'을 이용하는 방법은 단백질을 결정화할 필요가 없다. 단 '조그만 단백질(대략 분자량 5만 정도까지)'만 관찰할 수 있으며, 막단백질의 경우 용출할 떄 구조의 일부가 변하는 결점이 있다.
- 극저온 전자 현미경(Cryo-Electron Microscopy): '극저온 전자 현미경'을 이용하는 방법은 결정화할 수 없는 단백질이나 커다란 단백질도 관찰할 수 있으며, 적은 양의 단백질로도 관찰할 수 있다.
3. 단백질의 구조 해석법 1 'X선 회절'
'단백질 구조 분석(단백질 입체 구조를 조사하는 연구)'는 20세기 초에 X을 사용함으로써 시작되었다. 1895년 독일의 '빌헬름 뢴트겐(1845~1923)'이 X선을 발견하고, 1934년에 영국의 연구자가 위액 속의 효소 '펩신(Pepsin)'의 '결정(원자나 분자가 규칙적으로 배열된 고체)'에 X선을 쪼아 '회절상'을 얻는 데 성공했다. 이 'X선 회절(X-ray diffraction)'이 '단백질 구조 분석(Protein structure Analysis)'의 시작이 되었다.
'X선 회절'에서는 조사하려는 대상에 X선을 쏘고, X선이 산란되는 방식을 통해 시료를 구성하고 있는 원자의 배열을 조사한다. 다만 단백질 1분자에서 산란되는 X선은 매우 미약하다. 그렇기 때문에 그 X선은 도저히 관측할 수 없다. 그렇다고 해서 단순히 단백질의 양을 늘리면 수용액 속에서 방향도 제각각이고 모양도 변하는 단백질로 인해 X선이 난잡하게 산란되기 때문에 분석할 수 없다. 결국 방향이 일정한 단백질을 많이 사용해, X선을 일정한 방향으로 되돌아오게 하는 것이 중요하다. 순도가 높은 금속은 그 상태대로 많은 원자의 배열이 일정한 까닭에 선명한 회절상을 얻을 수 있지만, 단백질은 그대로 관찰할 수 없다. 그래서 대량의 단백질 수용액에서 수분을 빼서 분자의 방향을 일정하게 해야 하지만, 즉 '결정화(Crystallization)'해야 하지만 쉽지는 않다. X선 회절'을 통해 단백질 구조를 분석할 수 있는지는 이러한 결정화를 제대로 할 수 있느냐에 달려 있다.
결정화되기 쉬운 단백질이라면 'X선 회절'로 어느 정도 '분해능'이 높은 상을 얻을 수 있다. '분해능(Resolving Power)'이란 떨어져 있는 두 물체를 식별할 수 있는 능력을 말하며, 구조의 세밀함을 구분하는 정도를 나타낸다. 예를 들면 적혈구에 포함된, 산소를 운반하는 역할을 하는 '헤모글로빈(Hemoglobin)' 등의 단백질은 1950년대에 'X선 회절'로 입체 구조가 규명되었다.
그 후, '컴퓨터에 의한 데이터 수집'과 '분석의 자동화', '분석 소프트웨어의 개발', '회절상 기록용 카메라의 개량' 등이 이루어져 더 '휘도(일정한 넓이를 가진 광원 또는 빛의 반사체 표면의 밝기를 나타내는 양)'가 높은 '방사광'을 이용하는 기법도 등장했다. 빛의 속도에 근접한 고속을 전자를 가속한 후 이를 전자석으로 이용해 회전시키면 적외선-자외선-X선까지의 빛이 방출되는데, 이게 바로 '방사광(Synchrotron)'이다. 일본에서는 1997년에 'SPring-8(스프링 에이트)'라는 대형 방사광 시설이 만들어져, 매우 작은 결정도 자세히 분석할 수 있게 되었다. 다만 결정화가 커다란 장애라는 사실에는 변함이 없어, 특히 결정화되기 어려운 막단백질의 구조 분석은 그다지 진척되지 않았다.
4. 단백질의 구조 해석법 2 '핵자기 공명법'
이 밖에, 단백질을 그대로 분석하는 방법에는 '핵자기 공명(Nuclear Magnetic Resonanace)'법이 있다. 'NMR(Nuclear Magnetic Resonanace)법'은 관찰하려는 시료의 수용액을 '강력한 자기장 환경'에 놓고, 시료에 흡수된 전자기파의 형태를 조사해 입체 구조를 얻는 것이다.
일본의 경우 2002년부터 '특별히 중요시되는 3000종의 단백질'을 대상으로 그 기본 구조에 기능을 규명하는 '프로젝트 단백 3000(Protein 3000 Project)'이 추진되었다. 그때는 일본 이화학연구소 안에 있는 대규모 NMR 시설이 주로 사용되었다. 다만 NMR법으로는 커다란 단백질을 다룰 수 없다는 점과, 약품을 사용해 세포막에서 막단백질을 추출할 때 구조의 일부가 변한다는 것이 난점이다.
5. 단백질의 구조 해석법3 '극저온 전자 현미경'
5-1. 전자 현미경
'X선(X-ray)' 대신에 '전자선(Electron Beam, 고속 전자의 흐름)'을 사용해 확대된 상을 얻을 수 있는 것이 '전자 현미경(Electron Microscope)'이다. '전자 현미경'에는 '투과형 전자 전자 현마경(Transmission Electron Microscope)'과 '주사형 전자 현미경(Scanning Electron Microscope)'이 있다. 둘 다 현재까지 자동화나 고성능 카메라 탑재 등이 이루어져 과학 연구의 여러 분야에서 널리 사용되고 있다.
- 투과형 전자 현미경(Transmission Electron Microscope): 관찰하려는 시료에 전자선을 쏘았을 때 '투과한 전자'를 관찰하는 현미경
- 주사형 전자 현미경(Scanning Electron Microscope): '반사된 전자나 시료 표면에서 튀어나온 전자(2차 전자)'를 관찰하는 현미경
5-2. 단백질을 얼음 속에 가두어 관찰하는 '극저온 전자 현미경'의 개발
'전자 현미경(Electron Microscopy)'을 사용하면 단백질의 구조를 관찰할 수 있을 것 같지만 그리 간단하지는 않다. '전자선(Electron Beam)'은 공기 분자에 닿으면 잘 나아가지 못하기 때문에 관찰할 때는 시료를 진공 상태에 두어야 한다. 그렇게 하면 시료 속의 수분이 기화해서 말라 버려 단백질의 본래의 모양이 부서진다. 그래서 2017년에 노벨 화학상을 수상한 세 박사는 이 문제를 해결하기 위해 '극저온 전자 현미경(Cryo-Electron Microscopy)'을 개발한 것이다.
1970년대에는 -196℃ 이하의 '액체 질소'를 써서 단백질을 급속 냉동하려는 시도가 이루어졌다. 순간적으로 얼음 속에 가둠으로써, 단백질 모양을 유지한 채 진공 속에서 바로 마르는 것을 막을 수 있다고 생각했기 때문이다. 그렇지만 그 효과는 충분하지 않았다. 시료에 닿아 바로 기화하는 액체 질소가 단열재처럼 작용해, 급속 냉동을 할 수 없었던 것이다. 그래서 1984년에 -180℃ 정도의 액체 '에테인(Ethane)'을 병용하는 해결책을 제시한 사람이 '자크 뒤보셰(Jacques Dubochet)' 박사였다. 또 '요아힘 프랑크(Joachim Frank)' 박사는 1981년에 전자 현미경으로 얻은 '여러 방향에서 촬영한 대량의 2차원 평면 영상'을 바탕으로 '3차원 입체 영상'을 만드는 SPIDER라고 하는 획기적인 알고리즘을 개발해, '극저온 전자 현미경(Cryo-Electron Microscopy)'법에서 영상을 분석하는 방법을 확립했다.
'리처드 헨더슨(Richard Henderson)' 박사는 1970년대부터 분석하기 어려운 '막단백질(세포막에 묻혀 있는 단백질)' 관찰해 몰두해 온 선구지로, 그 후에도 이 분야를 이끌어 왔다. 전자 현미경 '상(Image)'의 분석법을 연구해 단백질의 '입체상(3-D Image)'을 얻고, '극저온 전자 현미경(Cryo-Electron Microscopy)'법을 통해 원자 수준에서 단백질의 입체상을 어든 것도 '리처드 헨더슨' 박사가 처음이었다. 더구나 '리처드 헨더슨' 박사는 더 정밀한 입체 구조를 얻기 위한 소프트웨어인 'RELION(REgularised LIkelihood OptimisatioN)'의 개발도 도왔다.
5-3. 2017년 노벨 화학상의 의미
'자크 뒤보셰(Jacques Dubochet, 1942~)', '요아힘 프랑크(Joachim Frank, 1940)', '리처드 헨더슨(Richard Henderson, 1945)' 세 박사가 노벨상을 받은 것은 매우 올바른 일이라고 생각된다. 노벨상에 필수적인 '세상에 크게 공헌했는가?'라는 점에서는 조금 이른 느낌이 있지만, 그만큼 앞으로의 응용에 대한 기대가 크다. 앞으로의 신약 개발 등에서 크게 공헌할 것으로 기대된다.
사실은 이번 수상에는 또 한 가지 의미가 있었다. 2013년에 '이판 쳉(Yifan Cheng)' 박사 등이 그때까지의 기술을 총동원해, 전자 현미경 상을 기록하는 고성능 카메라인 Gatan 사의 'K2 Summit'라는 전자선 직접 감지형 CMOS 카메라를 사용해, 결정이 되어 있지 않은 막단백질이라도 원자 수준에서 입체상을 얻을 수 있다는 점을 제시해 새로운 바람을 불러일으켰다. '이판 쳉' 박사 등은 혀에 있는 세포의 표면에서 매운맛의 근원이 되는 분자를 받아들이는 단백질 'TRPV1'의 구조를 자세히 조사해 세계를 놀라게 했다. 막단백질의 분석법이 크게 바뀌었따고 해도 지나친 말이 아니다.

5-4. 널리 사용되는 '극저온 전자 현미경'
'자크 뒤보셰(Jacques Dubochet)' 박사 등과는 달리 자신의 손으로 안정적이고 쓰기 쉬운 '극저온 전자 현미경(Cryo-Electron Microscopy)'을 세계에서 처음으로 개발한 것은, 일본 나고야 대학 세포생리학 연구센터의 객원 교수인 '후지요시 요시노리(藤吉好則)' 박사와 '일본 전자 주식회사'였다. '후지요시 요시노리(藤吉好則)' 박사는 1970년대 후반부터 '극저온 전자 현미경(Cryo-Electron Microscopy)'을 개발하며 막단백질 분석을 계속해왔다. 그는 1970년대 초에 전자 현미경을 사용하기 시작했지만, 전자선을 쏘면 단백질의 구조가 부서진다는 점 때문에 고민하고 있었다.
마침 그때, 독일 등의 연구팀이 '관찰하려는 시료를 -250℃ 정도 이하의 극저온으로 하면 전자선에 의한 충격을 줄일 수 있다'고 보고했다. 그래서 '후지요리 요시노리' 박사는 독자적으로 -269℃까지 냉각시킬 수 있는 액체 헬륨을 이용한 '극저온 전자 현미경' 개발에 나섰다고 한다. '극저온 전자 현미경'이라면 'X선 회절'로는 불가능한 분자량이 큰 단백질 복합체를 관찰할 수 있다는 장점도 컸다. 우선 냉각의 요체인 '액체 헬륨 부분으로 열이 유입되는 것으 차단하는 기술'과 '액체 헬륨이 끓으면서 일어나는 장치의 진동을 억제해 상을 선명하게 하는 기술'을 개발하고 1986년에 제1호기를 만들었다. 세계에서 가장 먼저 '극저온 전자 현미경(Cryo-Electron Microscopy)'을 팔기 시작한 것은 일본전자였다. 그 후 30년에 걸쳐 '자동화', '노이즈를 줄이기 위한 필터 탑재', '디지털 카메라 탑재' 등의 개량을 통해 2017년 6월에 최신신 'CRYO ARM™ 300'의 일반에 판매하게 되었다.
현재 세계적으로 가장 널리 이용되고 있는 것은 'TFS사(당시는 FEI사)'는 2006년에 자동화된 기종 'Titan Krios'를 발매하여 단숨에 점유율을 높였다. 그 후 2013년에 '이판 쳉' 박사가 결정화하지 않고 막단백질의 구조를 분석함으로써 더 높은 평가를 받게 되었다. 우리의 CRYO ARMTM 300'도 자동화를 꾀하고 고감도 CMOS 카메라를 탑재했다. 그리고 'Titan Krios'와는 다른 전자 발생 장치로 '냉음극 전자총(Cold Cathode Electron Gun)'을 채택해 분해능이 좋고 콘트라스트가 높은 상을 얻을 수 있게 되었다.

6.다양한 단백질 구조 분석 성과
'후지요시 요시노리(藤吉好則)' 박사는 다음과 같이 말했다.
나의 '극저온 전자 현미경' 개발은 거의 완료되었다고 할 수 있다. 결정이 아니라 그대로의 상태에서도 관찰할 수 있게 되어, 10년 이상 걸렸던 분석을 약 몇 개월 만에 할 수 있게 되었다. 직까지 결정을 얻을 수 없었던 막단백질을 점차 분석해, 오랫동안 꿈이었던 뇌의 신경 세포막에 있는 채널의 기능과 기억이나 학습 등 뇌의 고차원 기능과의 관련성을 밝히고 싶다.
6-1. 다양한 막단백질의 구조와 기능이 밝혀졌다.
'후지요시 요시노리(藤吉好則)' 박사는 자신이 개발한 '극저온 전자 현미경'을 써서 실로 다양한 막단백질의 구조와 기능을 밝혀 왔다. 식물의 광합성에서 중요한 광에너지를 모으는 '안테나 단백질(Antenna Protein)', 세포막에 묻혀 있으며 이온을 통과시키지 않고 물만 선택적으로 통과시키는 '물 채널(아쿠아포린-1, 아쿠아포린-4, 아쿠아포린-0)', '신경 세포와 근육의 접합부(신경근 접합부)'에 있는 '아세틸콜린 수용체(AChR, Acetylcholine Receptor)', 세포를 터널과 같은 구조로 서로 연결하는 '채널' 등이다.
그중에서도 '물 채널(Water Channel)'의 구조 분석은 물만을 선택적으로 통과시키는 메커니즘의 규명으로 이어져 세계적으로 높은 평가를 받았다. 물 채널 중에서도 '아쿠아포린(Aquaporin, AQP)'은 모든 생물에서 발견되며, 인간에게는 아쿠아포린-0부터 아쿠아포린-12까지 13종이 알려져 있다. '나트륨 이온(Na+)'이나 '수소 이온(H+)' 등의 이온을 일체 통과시키지 않고 물 분자만을 통과시키는 메커니즘은 수수께끼였지만, 물 채널의 복잡한 입체 구조를 바탕으로 물 분자 속의 수소의 방향이 그 열쇠임을 밝혀냈다.
2016년에는 '후지요시 요시노리(藤吉好則)'의 제자에 해당하는 '오시마 아쓰노리' 박사 등과 함께 세포끼리 접착시키는 막단백질 '이넥신 6(Innexin 6)'의 구조를 3.3Å이라는 원자 수준의 높은 분해능으로 규명했다. 참고로 '옹스트롱(Å)'은 1mm의 1000만분의 1에 해당하는 길이이다.
6-2. 세균의 편모 구조를 밝힌다.
'난바 게이이치(難波啓一)' 박사는 '후지요시 요시노리' 박사와 함께 '극저온 전자 현미경법' 개발에 참여하고, 마찬가지로 막단백질을 연구한 인물이다. '난바 게이이치' 박사는 생물물리학을 전문으로 하는 연구자이다. '생물물리학(Biophysics)'이란 물리학적인 사고방식과 기법을 사용해 생명을 이해하려는 학문으로, 물리학자들이 1950년~1960년대에 내세운 영역이다. '난바 게이이치' 박사는 대학원 시절에는 근육에 대해 연구했지만, 미국에 유학해 '단백질의 입체 구조'의 분석법을 배웠다.
일본으로 귀국한 후에는 '대장균(학명: Escherichia coli)'이나 '살모넬라균(Salmonella)'이 가진 '편모(세포 몸체에서 뻗어 나온 가느다란 채찍같이 휘갈기는 돌기)'에 대해 연구하기 시작했다. 대장균 등은 1개체당 몇 가닥의 편모를 가지고 있으며 한 다발로 묶은 것은 회전시킴으로써 돌아다닌다. '편모(Flagellum)'는 추진력을 내는 '프로펠러(Propeller)'의 기능을 맡고 있다. 그는 먼저 긴 섬유를 구성하는 단백질의 구조를 X선으로 조사하기 시작해 '플라젤린(Flagellin)'이라는 부품들이 결합해 나선 모양의 구조를 만드는 메커니즘을 밝혔다.
1991년부터는 '후지요시 요시노리' 박사에게 배워 '극저온 전자 현미경'을 쓰기 시작하며 함께 기술 개발에 전념했다. 2003년에는 4Å 분해능을 달성해, 편모 끝부분에서 '플라젤린(Flagellin)'이 만들어지는 메커니즘을 원자 수준에서 밝혀냈다. 그 후, 프로펠러를 돌리는 힘을 만들어 내는 근원부에 대해서도 '부품의 종류나 모양', '결합 방식' 등을 하나씩 조사해, 30개에 이르는 크고 작은 다양한 부품으로 구성된 구조와 모터처럼 고속 회전하는 부분의 구조를 밝히고 있다.
6-3. 근육이 고속 또는 높은 에너지 효율로 수축할 수 있는 메커니즘을 알아냈다.
또 '난바 게이이치' 박사는 2009년부터 근육이 고속 또는 높은 에너지 효율로 수축할 수 있는 메커니즘을 조사해, 오랫동안 수수께끼로 남아 있던 의문 하나를 풀어냈다. 근육의 수축 운동은 겹쳐 있는 2종의 섬유 '액틴 필라멘트(Actin Filament)'와 '미오신 필라멘트(Myosin Filament)'가 서로 사이로 미끄러지면서 일어난다. 그때 에너지원이 되는 물질 'ATP(아데노신 3인산)'가 어떻게 사용되는지, 또 높은 에너지 효율로 고속 수축할 수 있는지는 잘 알려져 있지 않았다.
그래서 연구실에 소속된 '후지이 다카시(藤井高志)' 박사와 함께 '액틴(Actin)'과 '미오신(Myosin)'이 결합한 상태의 섬유를 '극저온 전자 현미경'으로 촬영해 보았다. 그 결과, 일반적으로 액틴과 미오신은 붙거나 떨어지기를 반복하지만, 둘이 결합하면 미오신 분자의 끝이 변하고 그것이 ATP를 분해해 에너지를 내는 계기가 된다는 사실을 알아냈다. 또 필라멘트가 수축할 때의 에너지원으로써 ATP 외에 온실 정도의 열로 원자가 흔들리는 '열요동'이라는 현상도 이용하고 있음을 알아냈다. '열요동(Thermal Fluctuation)'이란 물질을 구성하는 입자들의 흔들리는 현상으로, 열에너지의 본질로 온도가 높을수록 요동이 커진다.
7. 신약 개발 등이 크게 발전하리라고 기대된다.
인체의 기능은 세포끼리 정보를 주고받으면서 유지된다. 결국, 세포 사이의 정보 전달에 관여하는 '막단백질(Membrane Protein)'에 정확히 맞는 약을 설계할 수 있다면 확실한 효과를 기대할 수 있다. 물론 막단백질의 구조가 중요하다는 점은 제약회사도 알고 있지만, 분석에 시간과 비용이 너무 많이 들기 때문에 나설 수 없었다. 만약 몇 개월 만에 구조를 분석할 수 있다면 많은 기업이 사용하려고 할 것이다. 그래서 '단백질 구조 분석' 서비스를 제공하는 회사도 설립되어 있고, 이미 많은 제약회사로부터 주문을 받고 있다고 한다. 앞으로는 '극저온 전자 현미경(Cryo-Electron Microscopy)'을 사용해 개발된 획기적인 '치료제'가 많이 등장할 것으로 기대된다. 실은 '극저온 전자 현미경'을 사용해 개발된 치료제는 아니지만, 이미 암이나 류머티즘 등의 약 가운데는 막단백질의 모양을 인식해 작용하는 '분자 표적 치료제(Molecular Targeted Therapy)'가 많이 개발되어 있다.
또 감염증 분야에서도 '극저온 전자 현미경(Cryo-Electron Microscopy)'의 이용이 기대되고 있다. 예를 들어 '편모(Flagellum, 세포 몸체에서 뻗어 나온 가느다란 채찍같이 휘갈기는 돌기)'는 세균이 감염 위치까지 이동하는 수단이므로, 편모의 형성이나 움직임을 억제함으로써 감염을 막을 수 있을 것이다. 실제로 편모가 형성되기 시작할 때 작용하는 단백질을 조사하고, 그 구조를 약간 바꾸는 것만으로도 편모가 성장하지 못한다는 사실이 확인되었다.
연구자가 분석한 단백질의 구조 데이터는 국제적인 데이터 뱅크인 '단백질 정보 은행(Protein Data Bank)'에 등록할 수 있으며 일반에 널리 공개되고 있다. '단백질 정보 은행(Protein Data Bank)'은 단백질 구조에 관한 데이터를 수집·정리·표준화하여 연구자가 정보를 쉽게 이용할 수 있도록 한 시설 및 장치이다. '펩티드의 아미노산 배열' 및 '단백질의 구조 정보' 등이 포함되어 있다. 등록 내역을 분석 기법별로 보면 X선에 의한 것이 압도적으로 많지만, 2013년 이후는 '극저온 전자 현미경(Cryo-Electron Microscopy)'에 의한 것이 급격하게 늘고 있는 추세이다.