단백질은 어떤 과정을 통해 만들어질까? 몸속에서 만들어지는 단백질의 원료는 우리가 섭취한 단백질이다. 그것이 우리의 몸속에서 '아미노산(Amino Acid)'으로 분해되어 'DNA'라는 '설계도'를 바탕으로 연결되어 단백질이 완성되는 것이다.
0. 목차
- 음식물 섭취
- 아미노산(Amino Acid)
- 펩티드 결합(Peptide Bond)
- 센트럴 도그마(Central Dogma)
- 앤핀슨의 도그마(Anfinsen's Dogma)
- 유전 암호의 기원
1. 음식물 섭취
우리의 몸은 항상 신진대사를 하고 있다. 몸속의 오래된 단백질이 새로운 단백질로 바뀌는 것이다. 음식물로 먹은 단백질은 우리 몸 속에서 새로운 단백질의 재료로 사용된다. 하지만 우리의 몸은 섭취한 단백질을 그대로 사용할 수는 없다. 먼저 위나 창자에서 단백질을 분해해야 한다.
단백질은 쇠고기나, 달걀, 콩 등에 많이 들어있다. 음식물은 입으로 들어와 식도를 지나 위로 보내진다. 위에서는 '펩신'이라는 소화 효소와 만난다. 펩신은 아미노산이 사슬처럼 연결되어 만들어진 단백질을 아미노산으로 분해한다. 보통 음식물에 들어 있는 단백질의 경우, 많은 경우 아미노산이 100개 내지 1000개 이상 연결된 것이다. '펩신'과 같은 분해 소화 효소는 가위처럼 이들 아미노산의 이음매를 잘라 버린다. 하지만 절단하려는 이음매에 따라 가능한 것과 불가능한 것이 있다. 단백질은 위, 십이지장, 소장에서 만나는 여러 가지 소화 효소에 의해 조금씩 이음매가 잘려 나간다. 이렇게 단백질은 조각이 나서 단일의 아미노산이나 아미노산이 둘이나 셋 정도로 이어진 사슬(펩티드)이 된다. 그것이 소장에서 혈액의 흐름을 타고 온몸의 세포로 여행을 떠난다. 단백질은 이렇게 분해되고 나서야 비로소 그 다음 단백질을 만드는 재료가 된다.
몸무게가 70kg인 사람의 경우 하루에 온몸에서 400g 정도의 단백질이 아미노산으로 분해된다. 그중 4분의 3 정도의 아미노산이 새로운 단백질을 만드는 재료로 사용된다. 나머지는 노폐물로 배출된다.
- 위의 작용: 위로 보내진 단백질은 위액에 들어 있는 펩신이라는 소화 효소에 의해 아미노산이 잘려나간다. '위소와(胃小窩; 관 모양의 위샘의 입구가 있는, 위 점막의 움푹 파인 부분)'에 있는 위샘에서 분비되는 위액에는 '펩시노겐'이라는 단백질이 들어있다.
- 십이지장의 작용: 단백질은 십이지장으로 보내져 췌장액(이자액) 속에 있는 트립신, 키모트립신 등의 소화 효소와 만난다. 이들도 아미노산의 이음매를 잘라 단백질을 잘게 만든다.
- 소장의 작용: 십이지장에서 온 단백질은 흡수 세포에서 분비되는 펩티다아제'라는 소화 효소에 의해 더욱 분해된다. 이리하여 단백질은 아미노산이나 아미노산이 둘이나 셋 정도로 이어진 펩티드로 분해되어, 흡수 세포에 들어가 '몸속'으로 들어간다. 흡수된 아미노산은 몸의 안쪽으로 방출되어 모세 혈관으로 들어간다. 그리고 온몸의 세포로 운반된다. 흡수 세포 사이에서는 분해되지 않은 단백질이 들어오기도 하는데, 이것이 알레르기의 원인 중의 하나가 되는 것 같다.
2. 아미노산(Amino Acid)
2-1. 아미노산 20종
모든 단백질은 '아미노산(Amino Acid)'이 사슬처럼 이어져서 만들어진다. 20종의 아미노산은 단백질의 공통된 부품이다. 부품이 공통이기 때문에 음식물 속의 단백질이나 몸속의 오래된 단백질을 분해해서 새로운 단백질의 재료로 이용할 수 있는 것이다.

2-2. 아미노산의 구조
모든 아미노산에는 '아미노기(Amino Group)'와 '카복시기(Carboxyl Group)'와 'R기(Side Chain)'가 있다. (프롤린의 아미노기는 약간 구조가 다름) R기는 아미노산의 성질을 결정한다. 아미노산끼리 연결되어 단백질이 되었을 때도 'R기'의 특징은 단백질의 성질에 영향을 미친다. 예컨대, 물과 친하기 어려운 R기가 연속하는 부분은 물과 반발해 단백질의 안쪽으로 접혀들기 쉽다. 단백질의 입체적인 구조는 주로 R기에 의해 정해진다. 'R기'는 20종의 아미노산에서 서로 다르며, 'R기'가 각 아미노산의 성질을 결정한다.
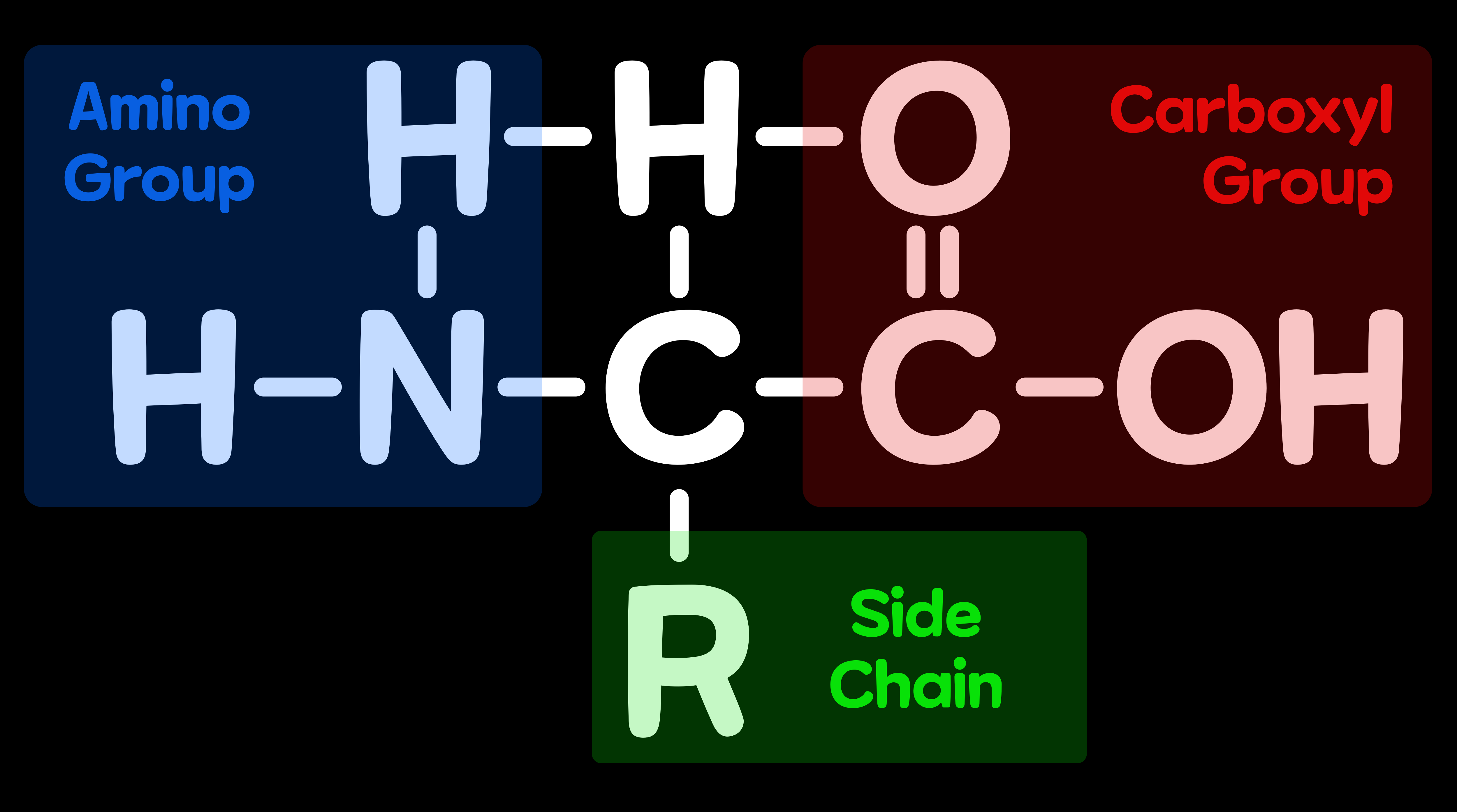
3. 펩티드 결합(Peptide Bond)
단백질을 구성하는 아미노산의 수는 수십 개에서 1만 개에 이르는 것까지 실로 다양하다. 하지만 어떤 단백질도 아미노산이 하나하나 이어져서 이루어진 것이다. 아미노산에는 아미노산끼리 이어지기 위한 '팔(Arm)'이 있다. 바로 '아미노기(Amino Group)'와 '카복시기(Carboxyl Group)'라는 부분인데, 이들 팔은 모든 아미노산에 갖춰져 있기 때문에 20종의 아미노산은 어떤 차례로도 이어질 수 있다. 아미노기와 카복시기가 '펩티드 결합(Peptide Bond)'으로 연결될 때 카복시기의 산소 원자 1개와 아미노기의 수소 원자 2개가 떨어진다. 이렇게 '펩티드 결합(Peptide Bond)'으로 연결된 아미노산 사슬이 단백질이다.
단백질은 아미노산으로 펩티드 결합으로 사슬 모양으로 이어진 것이다. 이어진 구조를 보면 중심에 '질소-탄소-탄소-질소-탄소-탄소'의 선이 생긴 것을 알 수 있는데 이 선을 '주사슬(주쇄)', 아미노산의 R기를 '곁사슬(측쇄)'라고 한다. 곁사슬이 어떤 차례로 이어지느냐에 따라 단백질의 성질이 결정된다. 리보솜에서 만들어지는 단백질의 맨 앞에 나오는 아미노산은 항상 '메티오닌(Methionine)'이다.
사람은 10만 종이나 되는 단백질을 만들 수 있다. 20종의 아미노산에서 10만 종의 단백질을 만든다고 하면 아미노산 종류가 너무 적다고 느껴질지도 모르겠다. 하지만 아미노산을 5개만 이어도 205= 320만 개의 경우의 수가 생긴다. 더구나 단백질의 아미노산 수는 제한이 없고, 그 수는 많은 경우 만 단위에 이른다.
4. 센트럴 도그마(Central dogma)
소장에서 흡수된 아미노산은 온몸의 세포로 운반되며, 세포 표면에서 흡수되어 새로운 단백질의 재료로 사용된다. 몸속의 세포에서 필요에 따라 단백질이 만들어지는 것이다. 단백질의 설계도, 즉 아미노산이 어느 순서로 이어지는가에 대한 정보는 세포의 핵 속에 있는 DNA에 적혀있다. 그러면 DNA를 설계도로 해서 어떻게 단백질이 만들어지는 것일까? 여기서는 '센트럴 도그마(Central Dogma)'의 전체 과정을 간단히 요약하자면 다음과 같다.
- DNA가 복제된다.
- DNA가 RNA로 전사된다.
- RNA가 편집된다.
- RNA의 정보가 단백질로 번역된다.
- 아미노산 사슬이 접혀 단백질이 완성된다.
4-1. DNA 복제
우리의 몸은 약 40조 개의 세포로 구성되어 있다. 이들 세포에서는 각 세포가 놓인 상태에 따라 여러 가지 단백질이 만들어지고 있다. 이러한 일이 가능한 이유는 단백질의 설계도인 'DNA'가 공유되고 있기 때문이다. DNA가 각 세포 사이에 공유될 수 있는 이유는 세포가 둘로 분열할 때 미리 DNA가 정확하게 복제되기 때문이다.
'DNA 복제'를 위해서는 먼저 'DNA 나선효소(DNA Helicase)'라는 단백질이 DNA의 한쪽 사슬과 결합해 이중 나선을 풀어나간다. 풀린 DNA의 사슬에는 'DNA 폴리메라아제(DNA Polymerase)'라는 단백질이 결합한다. 'DNA 폴리머라아제'는 DNA의 구성단위인 '데옥시리보뉴클레오티드(Deoxyribonucleotide)'를 주위에서 거들어들여 A와 T, G와 C의 짝을 만들면서 한 가닥의 사슬을 이중 나선으로 바꾸어 나간다. 한쪽 사슬에 결합한 'DNA 폴리메라아제(DNA Polymerase)'는 'DNA 나선효소(DNA Helicase)'를 뒤쫓는 것처럼 연속적으로 복제한다. 이 사슬을 선도 사슬(Leading Strand)라고 한다. 다른 한쪽의 사슬은 '선도 사슬'과는 반대 방향을 복제가 진행된다. 이 사슬은 '지체 사슬(Lagging Strand)'라고 한다. 지체 사슬에서, DNA는 '오카자키 절편(Okazaki Fragment)'이라는 짧은 조각들로 복제되었다가 나중에 연결된다. 이렇게 DNA는 복제되어 세포로 세포로 전해져 나간다.

4-2. 전사(Transcription)
핵 속에 있는 'DNA' 전체를 '게놈(Genome)'이라고 한다. 게놈은 모든 단백질을 만드는 방법에 대한 모든 정보가 기록된 일종의 '도서관'같은 것이다. 그리고 이 DNA의 정보 중에서 단백질 설계도 하나하나를 '유전자'라고 부르는데, 사람의 게놈에는 약 20000개~25000개 정도의 유전자가 기록되어 있다. 각각의 세포가 높인 상황에 따라 어떤 유전자를 복사할 것인지가 결정된다. 그런데 단백질은 핵 바깥에서 만들어지지만 단백질의 설계도를 가지고 있는 'DNA'를 핵 바깥으로 가져올 수 없다. 그래서 DNA에 쓰인 정보를 복사하고 그 복사한 것을 핵 바깥으로 가지고 나와야 한다. 그래서 DNA의 정보는 RNA로 복사되는데, 이 과정을 생물학에서는 '전사(轉寫, Transcription)'라고 부른다. RNA는 DNA와 아주 비슷한 물질이다. DNA가 A, T, G, C라는 4종의 염기를 가지고 있는 것처럼 RNA도 4종의 염기를 갖는다. 다만, RNA에서는 A, G, C는 DNA와 공통이지만 T대신에 U(우라실)이 사용된다.
어느 부분부터 DNA의 복사를 시작할지 결정하는 것은 '전사 기본 인자'라는 단백질이다. 이것이 DNA의 유전자 시작 부분(프로모터)에 결합하면, 거기에 RNA 폴리메라아제'가 결합해 복사가 시작된다. 'RNA 폴리메라아제(RNA Polymerase)'는 10개 이상의 단백질이 합쳐져 만들어진 장치이다. RNA 폴리메라아제는 다른 단백질의 도움을 받아, 복사하는 유전자의 선두 자리에 결합한다. 그 후 DNA의 이중 나선을 억지로 열고, DNA의 염기 배열을 복사한 RNA을 만들어 나간다. RNA가 만들어질 때에는, RNA의 선두 부분에 RNA가 분해되지 않도록 '캡 구조'라는 특별한 표지(보호기)가 붙는다. '캡 구조'는 3개의 인산기 앞에 '7메틸구아노신(염기의 구아닌이 변한 것)'이 결합한 화학 구조를 갖는다.
4-3. 스플라이싱(Splicing)
DNA를 복사해 만들어진 RNA는 그대로 핵 바깥으로 운반되는 것은 아니다. RNA가 핵 바깥으로 운반되기 전에는 '편집'이 이루어진다. DNA의 정보 안에는 단백질을 만드는데 무의미한 정보가 곳곳에 있다. 그래서 DNA를 복사한 RNA에도 무의미한 정보가 그대로 남아있다. 이 부분을 '인트론(intron)'이라고 한다. RNA를 단백질의 설계도로 완성시키기 위해서는 인트론을 제거한 후 의미가 있는 부분인 '엑손(Exson)'만을 연결해야 한다. 이 편집 작업을 'RNA 스플라이싱(RNA Splicing)'이라고 한다.
우선 '스플라이시오솜(Spliceosome)'의 2개 부품이 RNA의 인트론의 시작과 끝의 위치에서 결합한다. 이어 나머지 부품이 합쳐져 '스플라이시오솜(Spliceosome)'이 완성되고 인트론을 올가미 같은 모양으로 끌어당겨 인트론을 잘라낸다. 스플라이싱의 과정을 끝낸 RNA에는 그 표지로 된 '엑스포틴(Exportin)'이라는 단백질이 결합한다. 엑스포틴은 핵 바깥으로 나가는 통행증 역할을 하게된다. 이로써 '엑스포틴'이 결합한 RNA는 '핵막공(Nuclear Pore)'을 통과해 핵 바깥으로 운반된다. 엑스포틴은 핵 바깥으로 나가지 않는다.

4-4. 번역(RNA에서 단백질로)
핵 바깥으로 운반된 RNA(mRNA)는 단백질을 합성하는 공장인 '리보솜(Ribosome)'과 결합한다. 단백질의 재료는 우리가 식사로 섭취하거나 스스로 합성한 '아미노산'이다. 단백질의 형태는 20종의 아미노산이 어떤 순서로 연결되는가에 따라 결정되는데, 그 순서를 결정하는 것이 바로 RNA의 정보이다. RNA에 저장된 정보를 아미노산의 순서로 바꿔놓는 과정을 생물학에서는 '번역(Translation)'이라고 한다.
RNA의 염기는 4종이지만 아미노산은 20종이나 된다. RNA 염기는 3개의 문자가 1개의 아미노산에 대응된다. RNA의 암호와 아미노산의 대응은 모두 규명되었는데, 이 대응 관계를 표로 만든 것이 바로 '유전 암호표'이다. mRNA와 아미노산을 연결하는 것은 'tRNA'라는 분자다. tRNA는 분자 안에 2개의 중요한 부분이 있다. 하나는 아미노산과 결합하는 부분이고, 다른 하나는 암호인 mRNA의 염기 3개 문자(코돈)과 결합하는 부분인 '안티코돈'이다. tRNA는 특정 아미노산과 결합한 다음 리보솜으로 이동해 mRNA의 코돈과 결합한다. 리보솜이 mRNA 위를 움직여 나감에 따라 코돈이 지정하는 아미노산이 차례차례 운반되고, 그들이 염주처럼 이어져 나간다.

4-5. 단백질의 완성
단백질 합성은 아미노산을 늘어세웠다고 끝나는 것이 아니다. 단백질은 올바르게 접혀야 비로소 그 기능에 가장 접합한 형태를 가질 수 있다. 그러면 아미노산의 사슬은 어떻게 해서 적절하게 접히는 것일까? 사실은 아미노산 사슬은 기본적으로 접힌다. 사슬을 구성하는 아미노산은 그 아미노산의 종류에 따라 서로 끌어당기거나 서로 반발하고, 물과 친하기 어려운 아미노산끼리 모이는 성질이 있다. 이런 성질에 의해 사슬은 아미노산의 배열에 따라 안정적인 형태로 접힌다.
하지만 단백질이 접히기 전에 다른 단백질과 결합해 덩어리가 되는 '응집'이 일어나, 올바로 접히지 않는 경우가 있다. 그래서 이러한 경우에 대비하기 위해 세포 속에는 완성 전의 단백질이 올바로 접히는 것을 돕는 장치가 있다. 그것을 '분자 샤프로(chaperon)'이라고 한다. 샤프롱은 '보호자'라는 뜻으로, 대표적인 분자 샤프롱에는 'HSP60'이 있다. 합성 중인 단백질에는 분자 샤프롱의 일종인 'HSP70'이 결합해 '응집'을 방지한다. HSP70'이 떨어져 나가면 단백질은 단단히 접힌다. 한편, 'HSP60'은 '통' 같은 구조의 커다란 단백질로, 접히는 데 실패한 단백질에 '바로잡는' 기회를 부여하는 장치이다. 합성된 단백질 중에는 올바르게 접히지 못해 소수성을 가진 아미노산 표면이 노출된 경우가 많다. 이런 단백질은 HSP60의 내부에 끌려 들어간다. HSP60의 뚜껑이 닫히면 내부에 끌려간 단백질은 일시적으로 잡아당겨서 다시 한번 접힌다. 이로써 단백질이 잘못 접힌 것이 고쳐진다.
5. 앤핀슨의 도그마
단백질의 접힘은 아미노산을 사슬을 구성하는 아미노산의 순번에 따라 가장 안정적인 형태가 있어 자발적으로 그 형태가 되는 것이다. 이 개념의 발견자의 이름을 따서 '앤핀슨의 도그마(Anfinsen's Dogma)'라고 한다. 이 법칙은 단백질의 단백질의 접힘을 생각했을 때 가장 중요한 법칙 중 하나이다.
다만, 생체에는 다양한 단백질이 고밀도로 모여 있다. ;따라서 다른 단백질이 존재하는 경우 그들 단백질에 달라붙어 더 안정적인 형태를 취하는 경우도 있다. 광우병의 원인으로 여겨지는 '프리온(Prion)'이 그 예다. 사실 프리온이 될 수 있는 단백질은 인간의 정상적인 뇌 표면에도 있다. 여기에 비정상적인 형태인 프리온이 찾아오면, 이 비정상적인 형태의 프리온은 점차 정상적인 프리온을 비정상적인 형태로 바꾸어 나간다. 비정상적인 형태의 프리온이 만드는 섬유 모양의 구조는 매우 안정적인 형태라, 일단 그 섬유 모양이 되면 정상적인 형태로 되돌릴 수 없다고 여겨진다. 이런 섬유를 '아밀로이드(Amyloid)'라고 부른다. '알츠하이머병(Alzheimer's disease)', '헌팅턴병(lagging Strand)' 등 다양한 질병이 비정상 단백질인 아밀로이드와 관련이 있다.
최근에는 '천연 변성 단백질(Natural Denatured Protein)'이라는, 특정 형태로 접히지 않은, 일정한 형태를 갖지 않은 단백질도 다수 있다는 사실이 밝혀졌다. 다만 표적인 단백질이 있으면 형태를 만들어 결합한다. 상대에 맞추어 다양한 형태를 취할 수 있기 때문에 세포 내 정보 전달의 허브 역할을 하는 것으로 보인다. 그래서 아미노산의 사슬이 결정되기만 하면, 접히는 방식이 하나로 전해진다는 '앤핀슨의 도그마'도 수정되고 있다.
6. 유전 암호의 기원
지구상의 거의 모든 생물은 완전히 같은 유전암호를 이용한다. 그러면 생물이 사용하는 64가지 유전 암호는 과연 어떻게 정해진 것일까?
첫째 문자가 G, 셋째 문자열이 C인 유전 암호의 경우에는 GUC, GCC, GAC, GGC 등 네 가지가 있다. 이들 유전 암호는 발린, 알라닌, 아스파르트산, 글리신 등 4종의 아미노산에 각각 대응한다. 이들은 원시 지구상의 반응에서 생긴 단순한 구조의 아미노산으로, 가장 원시적인 아미노산이라고 할 수 있다. 게다가 이 4종의 아미노산이 거의 균등하게 들어 있도록 임의로 이으면, 생긴 것은 공 모양으로 접히고 물에 녹는 단백질이 될 수 있다. 그래서 이들 네 가지 유전 암호가 가장 원시적인 유전 암호라고 생각된다.
처음에는 이들 4종의 아미노산만으로 구성되는 단백질밖에 존재하지 않았다. 그 후 새로운 아미노산의 합성반응을 촉진하는 단백질이 나타나, 더욱 복잡한 구조를 가진 아미노산도 이용할 수 있게 되었다. 아미노산의 종류가 단계적으로 증가할 때 대응하는 유전 암호도 단계적으로 증가해 현재 최종적으로 64개의 유전암호가 완성된 것이었다. 이렇게 유전 암호가 최초의 네 가지 암호로 태어났다가 64개의 암호로 진화할 수 있었던 이유는, 그 배경에 유전 암호의 비율로 아미노산을 임의로 이었을때 생긴 사슬이 접혀 공 모양이 되고, 물에 녹는 단백질이 되는 아미노산의 조합이 있었기 때문인 것으로 생각된다. 이런 특별한 아미노산 조성을 '단백질의 0차 구조'라고 부른다.