단백질은 공이나 끈, 관, 모터 같은 것까지 실로 다양한 모습을 하고 있다. 단백질의 다양한 형태는 단백질의 작용, 나아가 인체의 기능과도 밀접한 관계를 가지고 있다. 이제까지 밝혀진 단백질의 형태와 그 작용에 대해 자세히 살펴보자.
0. 목차
- 몸을 유지하는 단백질
- 몸을 움직이기 위한 단백질
- 세포 안을 이동하는 단백질
- 음식물을 분해하는 단백질
- 산소를 운반하는 단백질
- 에너지 분자를 만드는 단백질
- 세균을 파열시키고 특정한 이물질을 붙잡는 단백질
- 정보를 전달하는 단백질
- 단백질의 형태와 의약품
- 단백질 형태의 예측
- 단백질의 구조해석
1. 몸을 유지하는 단백질
1-1. 콜라겐
피부는 누르거나 꼬집어도 탄력 때문에 곧 원래대로 돌아간다. 피부가 가진 탄력의 비밀은 세포 밖에 존재하는 가늘고 긴 '실'과 같은 단백질에 있다. 그 단백질 실의 대표적인 것이 바로 '콜라겐(Collagen)'이다. 아미노산 끈이 3가닥 모여 '삼중 나선'이라는 가늘고 긴 모양을 하고 있고, 이 실이 다시 더 모여 '콜라겐 섬유'를 만든다. 콜라겐 섬유는 다른 단백질 섬유와 그물코 구조를 만듦으로써 튼튼한 '천'이 완성된다. 피부나 소화관 등에서는 이런 단백질 실로 짜인 천이 세포를 유지하고 있어, 피부를 눌러도 곧 원래대로 돌아가는 탄력이 생기는 것이다. 콜라겐은 인체에 있는 단백질의 약 1/4를 차지하는 가장 풍부한 단백질이다.
1-2. 액틴
세포 안에서도 '세포 골격'이라는 단백질 섬유가 있어 세포의 모양을 결정한다. 바로 그 대표적인 예가 근육에도 있는 '액틴 섬유'이다. 찌그러진 공과 같은 액틴이 많이 이어져서 한 가닥의 실이 되고, 이어 두 가닥이 합쳐 꼬여 있다.
1-3. 튜불린
'세포 골격'의 또 다른 예는 세포 안에서 단백질 등의 물질이나 세포 소기관을 운반할 때 '길'이 되기도 하는 '미세 소관'이다. 이것은 '알파 튜불린(α-tubulin )'과 '베타 튜불린(β-tubulin)'이라는 2종의 '튜불린(Tubulin)'이라는 단백질이 연결되어 생긴 것으로, 안이 비어 있어 관 같은 모양을 유지하고 있다. '튜불린'은 우리의 몸을 분자 수준에서 유지시켜주는 '뼈대'가 되는 단백질이다. '미세 소관'은 세포가 분열할 때 염색체를 끌어당기는 끈으로도 작용한다.
2. 몸을 움직이기 위한 단백질
2-1. '액틴'과 '미오신'
우리가 팔이나 다리를 움직일 때에는 근육이 늘어나거나 오므라든다. 근육의 주된 재료인 '미오신(myosin)'과 '액틴(action)'은 이 신축성을 만들어 내는 작용을 한다. 근육이 신축할 때에는 액틴과 미오신의 섬유가 서로의 사이에 미끄러져 들어간다.
미오신은 기다란 끈의 끝에 2개의 팔이 있는 형태를 하고 있다. 미오신이 300개 정도 모인 미오신 섬유에서는 이 팔이 나와 있어 액틴 섬유를 붙잡아둘 수 있다. 그래서 근육이 수출할 때 미오신의 팔이 액틴을 잡아당기는 것이다. 이에 따라 미오신 섬유가 액틴 섬유 사이에 미끄러져 들어가므로 전체가 수축하게 된다.

3. 세포 안을 이동하는 단백질
세포 안에는 '미오신'처럼 움직이는 '분자 모터'가 또 있다.
3-1. RNA 폴리메라아제
세포 안에는 '미오신'처럼 움직이는 '분자 모터'가 또 있다. 먼저 세포 안의 핵에는 DNA를 바탕으로 RNA를 만들어 내는 'RNA 폴리메라아제'가 있는데, 이 단백질은 DNA를 '붙잡는 것'과 같은 형태를 하고 있다. 모노레일처럼 DNA를 따라 움직이며 그 정보를 판독하면서 DNA의 유전 정보를 mRNA에 복사해 나간다.
3-2. 키네신(kinesin)
세포 안에는 물질이나 세포 소기관을 운반하는 단백질의 하나인 '키네신(Kinesin)'이 있다. 키네신은 2개의 발을 가진 형태를 하고 있지만, 발이 1개인 것도 있다. 몇 가지 설이 있지만, 이 두 다리로 '미세 소관'의 위를 걷는 것처럼 이동한다고 생각된다. '다리' 부분으로 미세 소관의 바깥쪽을 걷는 것처럼 이동한다. 말하자면 '짐'을 붙여 나르는 세포 안의 '트럭'이다. 단백질은 극소에서 극대에 이르기까지 다양한 움직임을 만들어내고 있다. 포유류는 45종의 키네신의 유전자를 가졌음이 밝혀졌다.
4. 음식물을 분해하는 단백질
4-1. 소화 효소
가위와 창자 등에는 음식물을 낱낱이 분해하는 단백질 '소화 효소'가 있다. 이 '효소'들은 분자의 '가위'같은 역할을 한다. 소화 효소에서 분자를 자르는 날에 해당하는 부분은 '분해하고 싶은 상대'를 붙이는 움푹 팬 부분이다. 이 부분을 '활성 부위'라고 한다. '활성 부위' 안에 상대가 들어가면 화학 반응이 일어나 작은 분자로 절단된다. '활성 부위'는 마치 열쇠와 맞는 구멍처럼 상대와 꼭 맞는 형태를 하고 있다. 열쇠의 요철이 열쇠 구멍과 꼭 맞지 않으면 열리지 않는 것처럼, 다른 물질이 활성 부위에 달라붙어도 형태가 꼭 맞지 않으면 분해되지 않는다. 이 메커니즘에 의해 특정한 상태만 분해된다. 소화 효소를 몇 가지 소개한다.
- 알파 아밀라아제(α-amylase): 입속이나 창자에서 녹말을 분해하는 소화 효소.
- 펩신(Pepsin): 위에서 단백질을 분해하는 소화 효소. 화살표로 나타낸 움푹 팬 곳이 활성 부위이다.
- 트립신(Trypsin): 창자에서 단백질을 분해하는 소화 효소
4-2. 포도당 분해
분해되어 생긴 물질은 몸속에서 여러 가지 물질로 변한다. 그때에도 소화가 될 때와 마찬가지로 기본적으로는 하나의 반응은 하나의 효소가 담당하고 있다. 예컨대 포도당에서 에너지를 만들어 내는 과정을 '해당과정(Glycolysis)'이라고 한다. 이 과정에서 연속해서 일어나는 10가지 반응에서도 다양한 형태의 10개의 효소가 각각 하나의 반응에 관여하고 있다.
5. 산소를 운반하는 단백질
5-1. 헤모글로빈
우리는 산소를 필요로 한다. 폐에서 온몸으로 산소를 운반하는 것은 혈액 속의 적혈구에 있는 '헤모글로빈(Hemoglobin)'이라는 단백질이다. 4개의 단백질이 모여 헤모글로빈이 만들어진다. 4개 부분 각각에는 '헴(heme)'이라는 납작한 분자가 있는데, 거기에 산소를 붙인다. 헤모글로빈은 산소를 효율적으로 운반하기 위한 짐받이를 4개 가진 '트럭'같은 것이다. 산소가 1개의 헴에 붙으면 전체가 미묘하게 변해 다른 3개의 헴에 산소가 붙기 쉬워진다. 반대로 산소가 1개 떨어지면 형태가 바뀌어 다른 헴에서도 산소가 떨어지기 쉬워진다. 이런 메커니즘에 의해 산소를 '싣고 내리는 일'이 효율적으로 이루어진다.
헤모글로빈이 운반한 산소는 세포 안의 '미토콘드리아(mitochondria)'에서 ATP를 만들기 위해 이용된다.
5-2. 미오글로빈
헤모글로빈과 아주 비슷한 단백질로 '미오글로빈(myoglobin)'이라는 단백질도 있다. 이 단백질도 헤모글로빈과 마찬가지로 '헴'이 있는데, 거기에 산소를 결합한다. 헤모글로빈이 트럭이라면 미오글로빈은 '산소 봄베(산소통)'이라고 말할 수 있다. 향유고래가 오랜 시간 잠수할 수 있는 이유는 미오글로빈을 가지고 있기 때문이다. 온몸의 근육에 있는 미오글로빈을 마치 산소 봄베처럼 사용해 산소를 비축하고 나서 잠수를 시작하면 오랜 시간 물속에 머물 수 있다. 사람의 미오글로빈'도 '향유고래'의 것과 아주 비슷하지만, 구성하는 아미노산이 서로 다르다.
이런 아미노산의 차이를 조사하는 것은 생물의 '진화'를 생각하는데 힌트가 된다. 공통의 조상으로부터 갈라진 지 오래됐을수록 아미노산 이 많이 바뀐다. 그래서 아미노산의 차이를 조사함으로써 종이 갈라지고 나서 어느 정도의 시간이 흘렀는지 추측할 수 있다.
6. 에너지 분자를 만드는 단백질
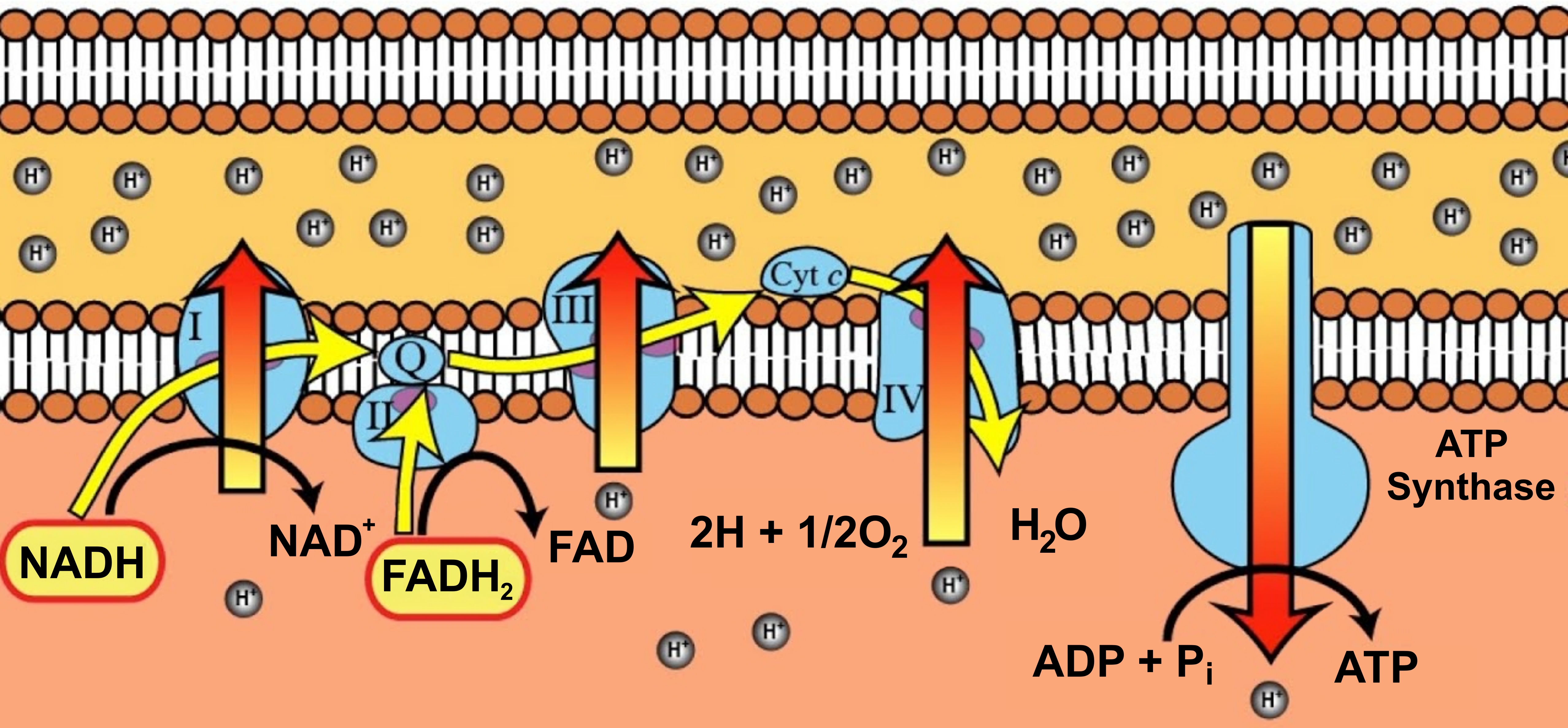
헤모글로빈이 운반한 산소는 세포 안의 '미토콘드리아'에서 ATP를 만들기 위해 사용된다. 미토콘드리아의 '내막'에는 막에 박힌 몇몇 단백질로 이루어진 '펌프'와 '모터'가 있다. 이들이 ATP를 만드는 공장이 된다.
단백질 펌프는 전자를 받아넘기면서 에너지를 꺼낼 수 있다. 헤모글로빈이 운반한 산소는 받아 넘겨지는 전자를 마지막에 받아들이는 데 쓰인다. 단백질 펌프는 이렇게 꺼내진 에너지를 사용해, 수소 이온을 미토콘드리아 내막의 바깥쪽으로 퍼내어 저장한다. 저장된 수소 이온은 수력 발전 댐에 저장된 물에 비유할 수 있다. 이 저장된 수소 이온을 이용하는 것이 'ATP 합성 효소(ATP synthase)'라는 단백질이다. 수력 발전에서 댐에 저장된 물이 흐르면서, 터빈을 회전시켜 발전하는 것처럼, 이 모터는 수소 이온을 통과시켜 그 흐름에 의해 실제로 회전하면서 ATP를 합성한다.
7. 세균을 파열시키고 특정한 이물질을 붙잡는 단백질
우리의 몸은 세균이나 바이러스 등의 공격에 노출되어 있다. 그러면 그런 공격으로부터 어떻게 몸을 지키고 있을까?
7-1. 리소자임
콧물이나 눈물 등에는 '리소자임(Lysozyme)'이라는 단백질이 있다. 리소자임은 소화 효소와 마찬가지로 물질을 산산조각으로 분해하는 '가위'라고 할 수 있다. 이 가위는 세균이 가지고 있는 '세포벽' 전용이다. 벽을 파괴함으로써 세균을 파열시킬 수 있다.
7-2. 항체
혈액에는 리소자임보다 더 강력한 방어 기능을 가지고 있다. 바로 '면역'인데 혈액 속에는 '항체'가 있으며 몸속을 돌면서 세균이나 바이러스 등의 이물질을 찾고 있다. 이 항체도 역시 단백질이다.
그중 하나인 '면역 글로불린 G(Immuno Globulin G)'는 2개의 '팔'을 가진 Y자 모양을 하고 있다. 항체는 이물질에 붙어 '표지(marker)' 역할을 한다. 두 팔에 의해 2개의 이물질에 붙음으로써, 2개의 이물질을 연결해서 모을 수 있다. 그들은 한꺼번에 면역 세포가 공격하는 것이다. 이 팔의 끝부분(항원 인식부위)은 인식하는 상대에 맞추어 각각 면역 '글로불린 G'로서 서로 다른 형태를 띠고 있다. 예를 들어 홍역 등의 감염증에 걸리면, 같은 병원체에는 저항력을 갖게 된다. 병에 처음 걸렸을 때 그 병원체에 맞게 형태를 갖춘 항체를 만들 수 있다.
8. 정보를 전달하는 단백질
우리가 무언가를 느끼거나 몸을 마음대로 느낄 수 있는 것도 단백질 덕분이다. 인체에서는 신경 세포의 네트워크가 뇌와 신경계에서 정보를 교환하고 있다. 그리고 이 정보의 교환은 세포와 안과 밖에서의 '전위차(전압)'의 변화에 의해 일어난다. 이온의 흐름을 조절해 이 변화를 만들어 내는 것은 '수문'처럼 여닫을 수 있는 단백질이다. 신경세포에는 2종의 수문이 있다.
8-1. 스위치가 연결되면 열리는 통
하나는 신경 세포끼리 신호를 전할 때 쓰이는 유형이며, 물질이 달라붙으면 수문을 열어 이온을 통과시킨다. 그 하나의 예가 '아세틸콜린 리셉터(AChR)'이다. '아세틸 콜린 리셉터'는 5개의 아미노산 끈으로 이루어진 가늘고 긴 통 모양을 하고 있으며, 세포막을 관통한다. 아세틸콜린이라는 물질이 달라붙으면 그 형태가 변해 이온을 통과시킬 수 있게 된다.
8-2. 이온을 통과시키는 출입구 (이온 채널)
다른 하나는 신경 세포 안 해서 신호를 전할 때 사용되는 '이온 채널'이라는 것이다. '칼륨 이온 채널'은 글자 그대로 칼륨 이온만을 통과시키는 단백질이다. 4개의 아미노산 끈으로 구성되며, 이것도 막을 관통하는 통 모양의 단백질이다. 세포 안에 존재하는 부분이 비틀어지면서 그 형태가 비틀어지면서 그 형태가 변해 이온이 지나는 길을 여닫을 수 있다.
9. 단백질의 형태와 의약품
지금까지 살펴본 것처럼 다양한 단백질의 형태가 규명되어 왔다. 이렇게 밝혀진 단백질의 형태는 미국, 유럽, 일본에 있는 세 가지 데이터베이스로 이루어지는 '프로틴 데이터 뱅크(Protein Data Bank)'에 등록되어 있다. 이렇게 밝혀진 데이터 총수는 2016년 8월까지 12만 2000건이나 된다.
9-1. SBDD
이렇게 밝혀진 단백질의 형태 정보를 활용하려는 새로운 움직임도 있다. 그중 하나가 형태를 바탕으로 새로운 의약품을 개발하는 'SBDD(Structure-Based Drug Desing: 구조에 바탕을 둔 약품 설계)'이다. 개발하려는 약의 표적이 되는 체내 단백질의 형태를 바탕으로, 그 단백질에 강하게 결합해 작용을 억제하는 물질을 컴퓨터로 설계하는 등 효율적으로 단기간에 신약 개발을 하려는 방법이다.
SBDD에 의해 개발된 약의 예로, 인플루엔자의 치료 약 '타미플루(Tamiflu)'가 있다. 타미플루는 인플루엔자 바이러스가 가진, 증식에 필요한 '뉴라미니다아제(neuraminidase)'라는 단백질 형태를 바탕으로 개발되었다. 뉴라미니다아제와 결합해 그 작용을 억제하는 신약을 컴퓨터로 형태에 맞추어 설계한 뒤 그것을 컴퓨터 시뮬레이션으로 실험한다. 이런 실험을 되풀이해 뉴라미니다아제에 강하게 달라붙으면서도 그 작용을 억제하는 물질 개발에 성공한 것이다. 바이러스 감영증에 그치지 않고 암 치료의 개발 등에서도 SBDD의 활약이 기대되고 있다.
10. 단백질 형태의 예측
지금까지 소개한 모든 단백질의 형태는 모두 아미노산의 끈이 접혀서 생긴 것이다. 하지만 현재까지도 접히는 규칙은 완전하게 밝혀지지는 않았다. 이 규명은 단백질 연구의 가장 어려운 관문 중에 하나이다. 단백질의 아미노산 배열은 DNA의 문자 배열에 저장되어 있다. 만약 아미노산 배열만으로 단백질이 어떤 형태가 되는지를 알 수 있다면, 게놈이라는 '설계도'에서 직업 어떠한 부품이 만들어지는 알 수 있다.
하지만 배열만으로 형태로 예측하는 일은 매우 어려운 일인 것 같다. 하나의 아미노산만 해도 구조는 하나가 아니라 다양한 구조를 취할 수 있다. 만약 그것을 대략 10가지라고 한다면, 아미노산 100개로 이루어지는 단백질에는 가능한 형태가 10^100가지나 된다. 이는 우주 전체에 있는 원자의 수보다는 많은 숫자이다. 단백질은 불과 몇 밀리초라는 짧은 시간에 막대한 가능성 중에서 하나의 형태를 취한다고 생각된다. 그래서 시뮬레이션만으로 오직 하나뿐인 이 형태를 찾아내는 일은 현재의 컴퓨터 능력을 최대로 이용하더라도 매우 어렵다.
11. 단백질의 구조해석
단백질 분자는 특정한 입체 구조를 취함으로써 비로소 기능을 발휘하게 되는 것이 많다. 그래서 단백질 분자의 입체 구조를 밝히는 일은 매우 중요하다. 하지만 나노미터 크기의 매우 작은 단백질 분자의 입체 구조를 직접 보기는 쉽지 않다. 그래서 현재는 간접적으로 단백질 분자의 입체 구조를 조사하는 방법이 사용되고 있다.
11-1. X선 결정 구조 해석
그중 단백질 분자의 입체 구조를 가장 많이. 밝혀낸 것이 'X선 결정 구조 해석'이다. 'X선 결정 구조 해석(X-ray Crystal Structure Analysis)'이란 X선 빔을 단백질 분자로 이루어진 결정에 비추어, 단백질 분자를 구성하는 원자의 3차원 배치를 조사하는 기법이다.
X선의 가는 빔을 단백질 분자의 결정에 비추면, X선은 결정 안의 원자에 의해 다양한 방향으로 산란된다. 산란된 파동은 서로 간섭해 보강되거나 상쇄되고, 회절 X선 결정으로 나오게 된다다. 회절 X선의 강도와 나오는 방향은 결정 속의 분자의 배열, 그리고 분자를 형성하는 원자의 3차원 배치에 따라 달라진다. 역으로 가능한 한 많은 회절 X선의 강도와 방향을 측정하면, 이에 근거하여 결정 속 원자의 3차원 배치를 알 수 있다. 즉, 단백질 분자의 입체 구조를 알 수 있다.
'X선 결정 구조 해석'의 장점은 '해석하는 단백질 분자의 크기'에 제약이 없다는 것이다. 따라서 거대한 단백질 분자의 입체 구조도 해석할 수 있다. 다만, 이 방법으로 입체 구조를 정확하게 조사하기 위해서는 분자가 제대로 정렬된 결정을 사용해야 한다. 단백질 분자의 결정은 단백질 분자를 물에 녹이고 온도, pH, 용액 속의 단백질 농도 등의 조건을 조절해 만들 수 있다. 하지만 결정이 되기 어려운 단백질 분자도 있어서, 그러한 단백질 분자의 입체 구조를 이 방법으로 파악하기는 어렵다.
11-2. 핵자기 공명(NMR)
'핵자기 공명(NMR: Nuclear Magnetic Resonance)'이라는 방법을 사용하면, 단백질 구조의 구조뿐만 아니라, 분자의 움직임이나 다른 분자와의 상호 작용도 알 수 있다. 다만, 이 방법으로 분자량이 큰 단백질 분자의 입체 구조를 밝히기는 어렵다.
그러면 NMR에서는 어떠한 원리로 구조를 해석하는 것일까? 강한 자기장 속에 놓인 단백질 분자에 전자기파를 비추면, 단백질 분자를 구성하는 원자의 원자핵이 원자의 종류에 따라 조금씩 다른 파장의 전자기파를 흡수한다. 그다음에는 흡수한 에너지를 전자기파로 방출하는 현상이 일어난다. 이를 '핵자기 공명'이라고 한다. 또 같은 종류의 원자에서도 주위에 어떤 원자가 있느냐에 따라 흡수, 방출하는 전자기파의 파장이 아주 미세하게 변한다. 따라서 어떤 파장의 전자기파를 흡수했는지를 파악하여 데이터를 분석하면, X선의 해석과 마찬가지로 단백질 분자의 입체 구조를 밝혀낼 수 있다.
실은 의료 현장에서 사용되는 'MRI(Magnetic Resonance Imaging, 자기 공명 영상)'도 이와 같은 원리이다. 인체를 강한 '전자기장(static magnetic field)' 속에 넣고 수소 원자의 핵을 공명시키는 주파수의 전자기파를 순간적으로 보내면, 인체 속의 수소 원자핵의 자기 공명에 의해 전자기파가 방출된다. 이 전자기파를 측정하여 분석하면, 인체 조직 내의 수소 원자의 분포를 계산할 수 있다.