0. 목차
- '무기 화학'과 '유기 화학'
- 화학의 역사
- 원소 분석 장치
- 원자의 손
- 원자의 결합
- 유기물의 골격
- 작용기(Functional Group)'
- 이성질체(isomer)
- 탄소의 특징
- 자연계의 유기물
- 인공 유기물
- '유기 화학'과 석유
- '유기 화학'과 약학

1. '무기 화학'과 '유기 화학'
'화학(Chemistry)'은 크게 '무기 화학(Inorganic chemistry)'과 '유기 화학(Organic chemistry)'으로 나누어져 있다. '무기 화학'은 원소 및 무기화합물을 다루는 화학 분야이고, '유기 화학'은 대부분의 탄소 화합물을 연구 대상으로 다루는 화학의 한 분야이다. 화학이 '무기 화학'과 '유기 화학'으로 갈라진 것은 대략 18세기 후반이다. 당시의 화학자들은 동식물이나 그것들로 만드는 술과 염료 등 '생물에서 얻어지는 것을 '유기물(Organic compund)'이라고 했다. 그리고 그 이외의 암석이나 물, 철, 금 등을 '무기물(Inorganic compound)'라고 했다. 현재 알려진 원소의 대부분은 '무기물'을 만들어낸다.
무기물은 어느 원소를 어느 정도의 비율로 포함하고 있느냐에 따라, 그 성질이 달라진다. 예컨대 전기를 통하는가, 물에 녹는가는 원소의 종류와 그 비율로 정해진다. 그래서 무기 화학 연구자들은 새로운 원소를 조합을 시도함으로써, 새로운 물질을 만들어 내거나 성질을 연구하고 있다.
한편, 유기물의 성질을 정하는 것은, 주로 '원소의 종류'가 아니라 '원소의 연결 방식'이다. 18세기 말에 유기물은 '탄소(C)', '수소(H)', '산소(O)', '질소(N)' 등 몇 종류의 원소로 이루어져 있음이 밝혀졌다. 유기물은 극히 일부의 원소로 이루어져 있음에도 불구하고, 무기물보다 그 종류가 매우 많다.
2. 화학의 역사
사람들은 고대 그리스 시대부터 주변의 물질이 무엇으로 되어 있는지 궁금증을 가졌다. 그러나 그것을 과학적으로 검증할 수 있게 된 것은 18세기 말 이후의 일이었다. 19세기가 되어서는 물질을 몇몇 원소로 분해하는 정밀한 장치가 발명되었다. 이 장치를 사용해 화학자들은 주변에 있는 것을 분해하고 조사하기 시작했다. 그리고 유기 화학자들은 유기물들을 조사하고, 그 결과를 서로 보고하게 되었다. 1860년대가 되어서는 이러한 노력에 의해, 다양한 원소의 '무게(Weight)'가 밝혀졌다. 그리고 원소를 가벼운 순으로 배열함으로써, 1869년에 '주기율표(periodic table)'가 탄생했다.
갓 태어난 주기율표에는 아직 채워지지 않은 곳도 많았다. 하지만 무기 화학자들에 의해 조금씩 미지의 원소가 발견되고, 원소에 관한 법칙도 차츰 밝혀졌다. 이 노력은 20세기에 들어와서, 실리콘을 이용한 '반도체'나 '리튬 이온 전지' 등의 발전으로 이어졌다. 유기 화학자들도 '새로운 약을 개발'하거나 '석유를 이용해 플라스틱이나 고무를 만들어 내는 등, 20세기 동안 다양한 것을 만들어 냈다. 또 석유 제품의 재활용 기술도 보급되었다. 21세기에 들어서 '유기 화학'은 'OLED 디스플레이(OLED display)' 등의 정밀 기기로도 응용되고 있다.
2-1. 무기 화학의 역사
- 기원전 5세기(4원소설): 고대 그리스의 철학자 '아리스토텔레스(기원전 384~기원322)'는 만물이 '4가지 원소(불, 공기, 물, 흙)'으로 이루어진다고 생각했다. 이 물질관은 그 후 2000년 이상이나 받아들여졌다. 연금술사들은 이 4가지 원소를 조작하면 '금(Ag)'을 만들 수 있다고 생각했고, 연금술이 발전했다.
- 18세기 말(화학 혁명): 앙투안 라부아지에(1743~1794)'는 주변의 물질을 분해하면, 결국엔 물질을 구성하는 '원소(element)'에 이른다고 생각했다. 그리고 '금(Ag)'이나 '수은(Hg)', '인(P)' 등 '원소의 후보'를 발표하였다.
- 1869년(주기율표의 발명): '드미트리 멘델레예프(1834~1907)'에 의해 주기율표가 발명되고 '원소의 법칙'이 밝혀졌다. 멘델레예프는 주기율표에 공란을 만들고, 미지의 원소의 원자량과 성질을 예언하였다. 그 후 예언대로 원소가 발견되었다.
- 1950년대(반도체, 전지 개발의 시작): 실리콘 결정을 이용한 '반도체'나, 이온을 이용한 '전지(Battery)' 등이 보급되었다.
2-2. 유기 화학의 역사
- 1930년 무렵(원소 분석 장치의 발명): 독일의 화학자 '유스투스 폰 리비히(1803~1873)'은 유기 화합물의 조성을 조사하는 정밀한 장치를 발명했다. '리비히'는 1830년 이후 대학에서 400명 이상의 학생에게 이 장치의 사용법을 가르쳤다.
- 1857~1865년(탄소의 구조를 규명): 독일의 화학자 '프리드리히 아우구스트 케쿨레(Friedrich August Kekulé von Stradonitz, 1829~1896)'는 유기물 원자의 '연결 방식'을 밝혀냈다. 또 가스 등에서 발견된 '벤젠(C6H6)'의 분자 구조도 규명했다.
- 1920년(석유 화학 공업의 시작): 석유를 이용해 천이나, 플라스틱, 고무 등 다양한 인공 유기물을 만들게 되었다. 또 재활용 기술의 보급이나 생분해성 플라스틱도 개발되고 있다.
- 2000년(분자를 조립하는 시대로): 21세기에 들어서는 설계한 분자를 자유롭게 만들 수 있게 되었다. 분자와 분자를 조합시킨 '분자 기계(molecular machine)'나 분자가 빛을 내는 'OLED 디스플레이(OLED display)' 등이 개발되었다.
2-3. 화학 혁명
고대부터 사람들은 모든 물질은 '4가지 원소(물, 불, 흙, 공기)'로 이루어진다는 아리스토텔레스의 설을 오랫동안 믿어왔다. 그러다 아리스토텔레스의 설과 근본적으로 다른 설이 나타난 것은, 2000년 이상이나 지난 18세기 후반의 일이다. 이 무렵에는 아직 화학을 가르치는 전문적인 학교나 연구소가 없었으며, 화학자들은 대부분은 다른 일을 하면서 틈틈이 연구를 하는 정도였다. 프랑스의 화학자 '앙투안 라부아지에(Antoine Lavoisier, 1743~1794)'도 자신의 실험실에서 물체가 연소하는 모습이나 결정이 생기는 모습을 되풀이하면서 관찰하던 화학자 중에 한 명이었다. 그 결과, '라부아지에'는 물질이 어떻게 구성되어 있는가에 대한 새로운 견해를 가지게 되었다.
'라부아지에'는 '물질은 다양한 원소로 되어 있으며, 주변의 물질을 계속 분해하다가 더 이상 분해할 수 없는 물질이 발견된다면 그것이 원소다.'라고 주장했다. 그리고 원소의 후보로 '철(Fe)', '금(Au)', '은(Ag)', '산소(O)', '수은(Hg)', '인(P)', '석탄(coal)', '빛(light)', '열(heat)' 등 30종이 넘는 물질을 제시했다.
물론 현재에는 빛과 열 등은 원소가 아니라는 사실이 밝혀져 있다. 하지만 라부아지에의 새로운 견해는 다른 화학자들에게 커다란 영향을 주었고, 새로운 원소가 발견되는 원동력이 되었다. '라부아지에'의 제안을 계기로, '유스투스 폰 리비히(Justus Freiherr von Liebig, 1803~1873)' 등의 많은 화학자들은 라부아지에를 견해를 따라 주변의 물질들을 살펴보기 시작했다. '라부아지에'가 이끈 18세기의 '화학 혁명(Chemical revolution)'은 물질에 대한 탐구로서 '화학(Chemical)'을 근대과학의 한 분야로 이끈 중요한 계기가 됐다.
3. 원소 분석 장치
'라부아지에'는 물질을 계속 분해하면 원소에 도달한다고 주장했다. 그러면 19세기의 화학자들은 어떻게 물질을 분해했을까?
당시 유기물의 다수는 태우면 몇 종류의 기체가 되어 사라진다는 사실이 알려져 있었다. 그래서 화학자들은 이 기체를 종류마다 그 무게를 재면, 유기물에 들어 있는 원소의 비율을 구할 수 있으리라 생각했다. 그러나 태워서 발생한 기체를 정확하게 모아 무게를 재기란 너무나 어려운 일이었다.
이 문제를 해결한 사람이 독일의 화학자 '유스투스 폰 리비히(Justus Freiherr von Liebig, 1803~1873)'이다. '리비히'는 1830년경, 유기물에 포함된 탄소·산소·수소를 정확하게 조사할 수 있는 '원소 분석 장치'를 발명했다. 그리고 그 장치는 리비히의 제자들에 의해 전 유럽으로 퍼졌고, 많은 화학자들이 사용하게 되었다. 이 장치를 사용하면 탄소·산소·수소의 비율을 예컨대 1:1:2, 6:5:10 등으로 구할 수 있었다. 그리고 그 비율은 유기물마다 무수히 있음이 알려지기 시작했다. 그 비율은 너무나 많아서, 독일의 화학자 '프리드리히 뵐러(Friedrich Wohler, 1800~1882)'는 '유기물의 세계는 마치 어두운 밀림과 같다.'라는 말을 남기기도 했다. 아래의 표는 당시에 구한 유기물에 들어 있는 탄소, 수소, 산소의 비율을 다양한 정수비로 나타낸 것이다.
| 유기물 | 탄소(C) | 수소(H) | 산소(O) |
| 벤젠 | 1 | 1 | 0 |
| 에틸렌 | 1 | 2 | 0 |
| 포도당 | 1 | 2 | 1 |
| 부타디엔 | 2 | 3 | 0 |
| 녹말 | 6 | 10 | 5 |
| 젖당 | 12 | 22 | 11 |
4. 원자의 손
4-1. 탄소는 손을 4개 가지고 있다?
'리비히'가 발명한 '원소 분석 장치'에 의해 막대한 종류의 유기물이 조사되고, 그들은 모두 탄소 등 소수의 원소로 이루어져 있음이 밝혀졌다. 그리고 다양한 유기물에 대해 탄소·산소·수소의 비율이 구해졌다. 당시의 화학자들은 이들 성과로부터, 물질은 더 이상 분해할 수 없는 '원자'로 이루어져 있다고 생각했다. 그래서 화학자들은 탄소·산소·수소 등의 원자가 조합되어 생기는 '분자의 모양'이 '유기물의 성질'의 차이와 관계있지 않을까 생각하게 되었다. 그리고 화학자들은 다양한 분자의 모습을 추리하게 되었다.
'리비히'의 '원소 분석 장치'가 탄생한지 20년이 지난 후, 먼저 영국의 화학자 '에드워드 프랭클랜드(1825~1899)'가 '원자는 각각의 손을 가지고 있으며 서로 손을 잡고 결합한다.'라고 주장했다. 그리고 1858년에는 독일의 화학자 '프리드리히 케쿨레(1829~1896)'가 '산소는 2개의 손을 가지고 있고, 수소는 1개의 손을 가지고 있다.'라는 설을 소개했다. 이어 '탄소는 4개의 손을 가지고 있어, 한 번에 4개의 원자와 결합할 수 있다'는 설과 '탄소끼리도 결합할 수 있다.'라는 새로운 설을 발표했다. 그리고 나중에는 '한 번에 이중·삼중으로 손을 이어 결합할 수 있다'는 설을 추가했다.
또 네덜란드의 화학자 '야코뷔스 헨리퀴스 판트 호프(네덜란드어: Jacobus Henricus van't Hoff, 1852~1911)'는 '탄소의 손은 사방으로 퍼져 있다'는 설을 주장했다. 이 당시의 케쿨레의 설은 하나의 가설에 불과했다. 하지만 이 설로 다양한 '유기 화합물(organic compounds)'의 성질을 설명할 수 있었고, 케쿨레의 주장은 점차 화학자들에게 받아들여지기 시작했다.
4-2. 원자의 손의 정체
그러면 탄소가 가진 손의 정체는 무엇일까? 1958년 케쿨레가 원자의 연결 방식을 예상했을 때, 원자가 어떤 것이지는 알지 못했다. 그러다 1871년에 러시아의 화학자 '드미트리 멘델레예프(1834~1907)'가 원소의 주기율표를 발표했다. 그리고 1913년에는 '닐스 보어(Niels Bohr, 1885~1962)'가 원자의 구조를 제안함으로써, 드디어 탄소가 가진 4개의 손의 정체가 밝혀지게 되었다.
보어는 원자가 '원자핵(atomic nucleus)'과 그 주변에 존재하는 '전자(electron)'으로 되어 있다고 생각했다. 전기는 음전기를 띠고 있으며, 또 원자핵에는 양전기를 띤 '양성자(proton)'이 '전자'와 같은 수만큼 있다. 원자의 종류는 이 '양성자'가 몇 개 있느냐에 따라서 결정된다. 예컨대, 수소는 1개씩, 탄소는 6개씩, 산소는 8개씩 '양성자'와 '전자'를 가지고 있다.
또 전자의 궤도는 하나가 아니며, 양파 껍질처럼 여러 층으로 되어 있다. 궤도에 들어갈 수 있는 전자의 수는 각각 정해져 있으며, 첫 번째 궤도에 2개, 두 번째 궤도에 8개의 전자가 있을 때 안정된다. 예컨대 '네온(Ne, 원자번호 10번)'은, 첫 번째 궤도에 2개, 두 번째 궤도에 8개의 전자가 들어 있다. 두 번째의 궤도가 전자로 꽉 차 있기 때문에, 네온은 매우 안정된 원자이다. '탄소(C)'는 첫 번째 궤도에 2개, 두 번째 궤도에 4개의 전자가 있다. 만약 2번째 궤도에 4개의 전자가 더 있다면 두 번째 궤도를 다 채울 수 있어서, 탄소는 4개의 '빈 자리'를 채우려고 한다. '케쿨레'가 제안한 '4개의 손'의 정체는 '탄소 원자가 가진 4개의 '전자'와 4개의 '빈자리'를 말하는 것이었다.

5. 원자의 결합
탄소 원자가 가장 바깥쪽의 껍질에 4개의 '전자'와 4개의 '빈자리'를 가지고 있듯이, 마찬가지로 '수소 원자'는 1개의 전자와 1개의 빈자리를 가지고 있다. 수소 원자가 2개 있을 때 가지고 있는 전자를 1개씩 내밀어 공유하면, 겉보기에는 모든 원자가 전자를 2개 가진 상태가 된다. 이로써 한 몸이 된 모임을 '분자'라고 하며, 이처럼 전자를 공유해 '분자(molecule)'를 만드는 결합을 '공유 결합(covalent bond)'이라고 한다.
탄소 원자도 수소와 마찬가지로 분자를 만든다. 단, 탄소에는 4개의 빈자리가 있으므로, 탄소 원자 하나와 수소 원자로 분자를 만드려면 '수소 원자'가 4개 필요하다. 이 분자는 유기 화학물 중에서 가장 기본적인 분자로 '메탄(CH4)'라고 불린다. 탄소는 반드시 4개의 손을 다 써서 궤도를 채우려고 한다. 이때 탄소 원자는 다른 원자들과 결합하면서, 무수히 다양한 형태의 분자를 만들어 낸다. 예컨대 탄소 원자 2개와 수소 원자 6개가 공유결합해서 '에탄 분자(CH3CH3)'를 만든다던가, 탄소 원자 3개와 수소 원자 8개가 결합하여 '프로탄 분자(CH3CH2CH3)' 등을 만든다.

5-1. 탄소는 이중, 삼중으로도 결합할 수 있다.
탄소는 전자를 2개씩 내밀어 궤도의 2개의 빈자리를 채워 이중으로도 결합할 수 있다. 탄소 원자 둘과 수소 원자 넷이 전자를 공유해서 '에틸렌 분자'가 형성된 모습이다. '에틸렌(ethylene)'은 탄소끼리 2개씩 전자를 공유하고, '이중 결합(double bond)'을 하고 있다. 분자 모형에서는 2가닥의 막대로 이중 결합을 나타낸다. 또 탄소는 3개의 전자를 서로 내밀어 삼중으로 결합할 수도 있다. 매우 불안정해서 곧 부서지기는 하지만, 탄소 원자가 사중으로 결합한 예도 실험실에서 확인되었다.
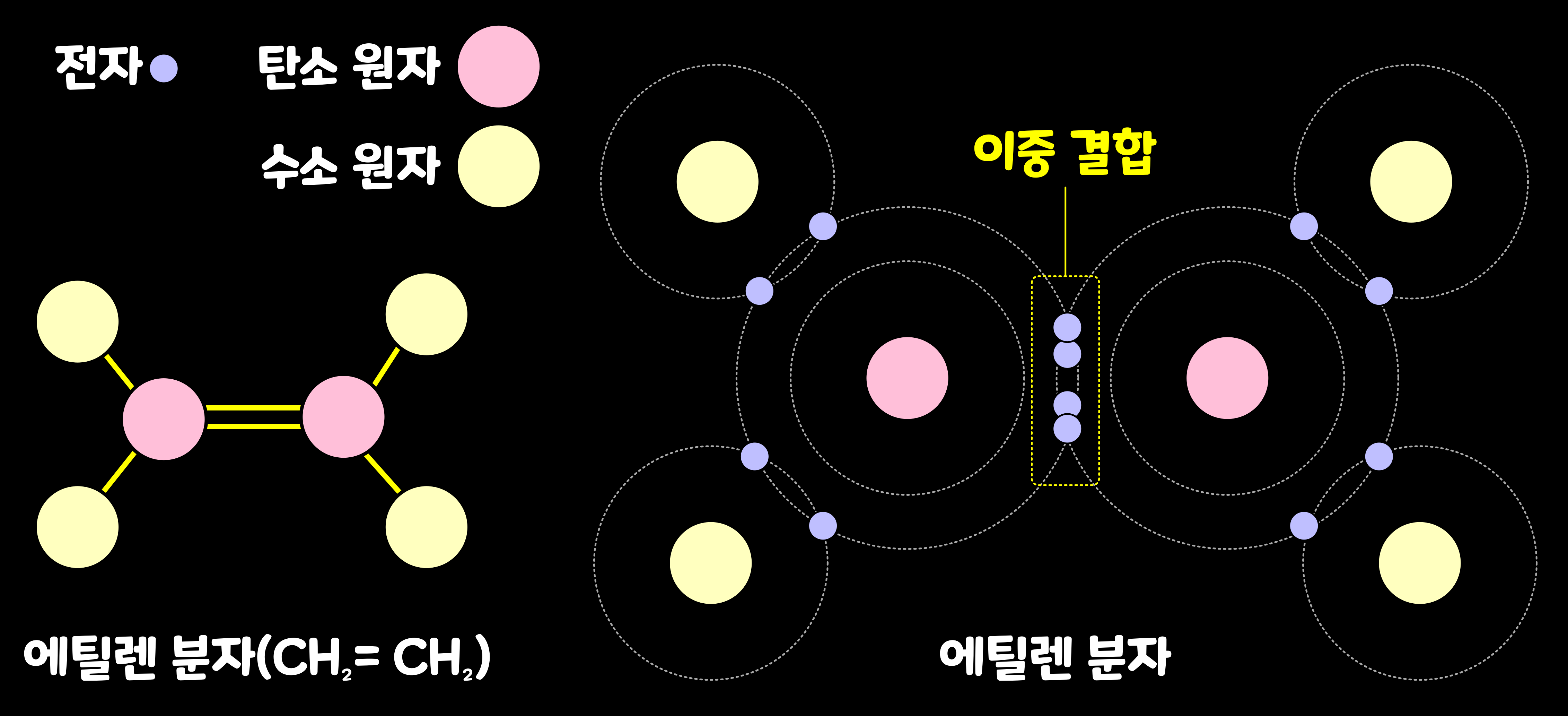
6. 유기물의 골격
탄소 화합물은 구분은, 주로 '화합물의 구조'에 따라 '지방족 화합물(Aliphatic Compound)'과 '방향족 화합물(Aromatic Compound)'로 나눈다.
6-1. 지방족 화합물(Aliphatic Compound)
19세기의 화학자들은 '유기 화합물'을 조사하는 과정에서 화합물의 분자에 공통되는 부분이 있음을 알게 되었다. 많은 분자가 탄소 사슬처럼 길게 이어진 구조나 탄소가 고리처럼 이어진 구조를 하고 있었던 것이다. '사슬'의 대표적인 예는 탄소끼리 단일 결합으로 길게 이어진 분자이다. 사슬 중간에 있는 탄소는 2개의 손을 써서 이웃하는 탄소와 이어지고, 남은 2개의 손으로 각각 수소와 결합한다.
이 수소 부분은 다른 원자들과 바꿀 수 있어서, 탄소는 '유기물의 골격'이 된다. 이처럼 탄소와 수소의 결합으로 이루어지는 가장 단순한 유기물을 '지방족'이라고 한다. 지방 분자도 이와 같은 길게 이어진 탄소의 사슬을 가지고 있어서, 이들 분자를 '지방족'이라고 부르게 되었다. 단일 결합의 사슬 외에도 '이중 결합', '삼중 결합'을 가진 분자도 포함한다. 단, 벤젠 등의 방향족은 제외한다.
탄소의 사슬은 이어져 있는 탄소의 수에 성질이 달라진다는 사실이 알려져 있다. 탄소가 1~4개일 때는 기체이지만, 15~20개가 이어지면 양초의 왁스가 된다. 그리고 수십~수십만 개의 탄소가 이어지면 비닐봉지의 원료인 '폴리에틸렌(Polyethylene)'이 된다.
6-2. 방향족 화합물(Aromatic Compound)
고리를 가진 분자의 대표적인 예는 19세기에 보급되었던 가스등의 석탄 가스에서 발견된 '벤젠(Benzene)'이다. '벤젠'은 발견되고 나서 잠시 동안 어떤 형태를 가지고 있는지 알지 못했다. 그래서 연구자에 의해 그 모습이 여럿 제안되었다. 그러다 그 정체를 밝힌 사람은, 탄소 원자가 4개의 손을 가진다는 사실을 간파한 '프리드리히 아우구스트 케쿨레(Friedrich August Kekulé von Stradonitz)'였다.
케쿨레는 '벤젠(Benzene)'은 6개의 탄소가 단일 결합과 이중 결합으로 연결되어, 고리 모양으로 된 분자라고 생각했다. 그리고 벤젠의 탄소는 각각 1개의 수소와 결합하고 있으며, 이 수소는 탄소의 사실과 마찬가지로 다른 원자 등과 바꿀 수 있다고 생각했다. 벤젠처럼 '단일 결합'과 이중 결합'으로 고리를 만드는 물질의 일부는, 고리 모양을 그대로 보존한 채 수소를 다양한 '장식'으로 바꿀 수 있다. 이들 물질은 향기를 갖는 것이 많기 때문에 '방향족'이라고 불리게 되었다. 결합하고 있는 전자의 상태에는 몇몇 종류가 있는데, 이중 결합이나 삼중 결합의, 2개 이후의 경우를 '파이 결합(π 결합)'이라고 한다. '방향족'인지 아닌지는 정확하게는 고리 모양의 분자가 '파이 결합(π 결합)'을 '2n+2(n=1,2,3, ...)개' 가지고 있느냐에 따라 결정된다.
그 후에 만들어진 도료나 의약품 등의 유기 화합물의 대부분은, 대부분은 벤젠을 포함하는 '방향족 화합물(Aromatic compound)'이었다.

7. 작용기(Functional Group)'
7-1. '장식'이 유기물의 성질을 결정한다.
가정용 가스에 쓰이는 '프로판(C3H8)'은 수소 원자 중 1개를, 산소와 수소로 이루어진 '히드록시기(-OH)'라는 '장식'으로 바꾸면 '프로탄올(C3H7OH)'이라는 액체가 된다. '프로판올'은 화장품이나 잉크 등에 쓰이는 소재이다. 원래 '프로판(Propane)'은 전혀 물과 섞이지 않지만, '프로판올(Propanol)'은 물에 섞일 수 있다. '히드록시기(Hydroxyl group)'가 물을 닮은 '-OH'라는 구조를 가지고 있기 때문이다. 이처럼 유기 화합물의 성질은 그 화합물이 어떤 '장식'을 가지고 있느냐에 따라 결정된다. 이들 '장식'은 '기능을 부여하는 부분'이라는 뜻에서 '작용기(Functional Group)'라고 부른다.
'히드록시기'에는 이런 능력이 있는 이유는, 원자의 종류에 따라 전자를 잡아당기는 힘이 다르기 때문이다. 예컨대 히드록시기처럼 산소와 수소가 전자를 공유해서 결합하고 있을 때, 전자는 2개의 원자에서 잡아당겨진다. 이때 산소는 수소보다 강하게 전자를 끌어당긴다. 그러면 산소는 근소하게 '음(-)'의 전기를 띠고, 수소는 근소하게 '양(+)'의 전기를 띤다. 이러한 전기의 치우침 때문에, '물에 섞이는 성질'이 있고 '화학 반응을 하는 성질'을 가지게 된다.
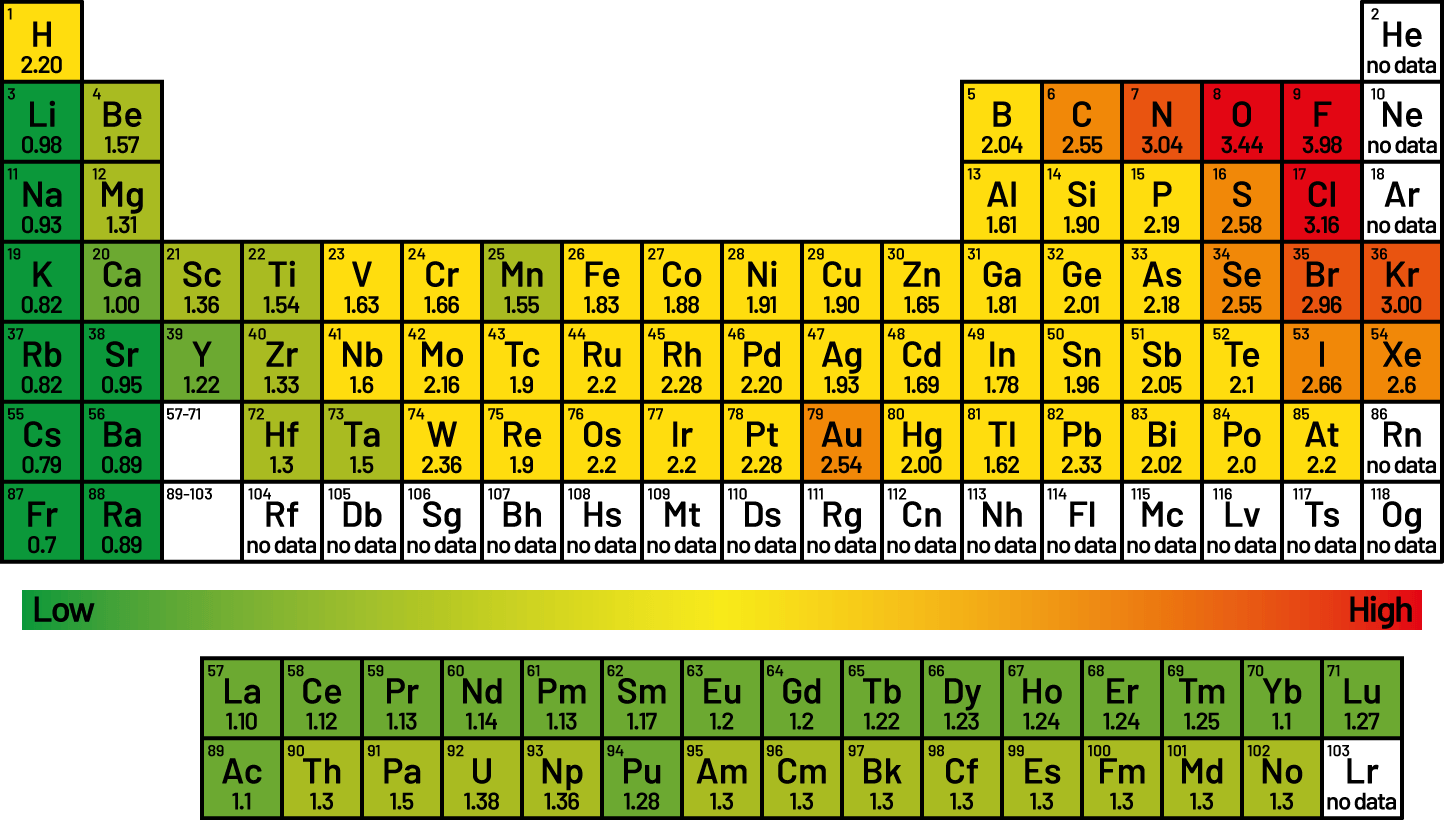
유기 화합물의 일부는 '골격'의 역할을 하고, '장식'인 작용기는 다양한 화학 반응을 한다. 그러면 '골격'과 '장식'의 역할 분담은 어떻게 정해질까? 대부분의 '화학 반응'은 분자 안의 '전기의 치우침'이 있는 곳에서 일어난다. 그리고 '전기의 치우침'은 원자가 전자를 잡아당기는 세기의 차이에서 생겨난다. 예컨대 탄소와 산소가 공유 결합'을 하고 있을 때 산소는 탄소보다 강하게 전자를 잡아당긴다. 그래서 전기의 치우침이 생기므로, 탄소와 산소의 결합은 '작용기'가 되기 쉽다. 한편, 수소와 탄소는 전자를 잡아당기는 세기가 비슷한 편이다. 그래서 탄소와 수소의 결합은 '작용기'가 되기 어렵다. 탄소와 리튬이 결합하면, 이번에는 탄소가 전자를 잡아당기는 세기가 더 커서 음전기를 띤다. 이처럼 탄소는 결합하는 상대에 따라 성질을 크게 바꿀 수 있다. 전자를 잡아당기는 세기를 '전기 음성도(Electronegativity)'라고 한다.
7-2. 대표적인 작용기
아래에 일반적인 '작용기(Functional Group)'를 정리했다. 골격과 골격을 잊는 경우에는 '~ 결합'이라고 부르는 경우가 많다.
- 히드록시기(Hydroxyle Group): '술(알코올)' 분자에 붙어있는 작용기이다. 'OH'의 부분이 '물 분자(H2O)'를 닮아서, 히드록시기가 있으면 물이 섞이기 쉽다. 또 당의 분자에도 여럿 붙어 있기 때문에 '당(Sugar)'도 물에 잘 섞인다.
- 에테르 결합(Ether Linkage): 물에 녹지 않는 '유기물'을 녹이는 작용기이다. '디에틸에테르[(C2H5)2O]'라는 물질은 마취제의 일종으로 알려져 있다. 다양한 시료를 녹이는 '용매'로 쓰인다. 대부분의 시약에 대해 반응하지 않는 안정된 물질이다.
- 카르보닐기(Carbonyl Group): 인체에 유해한 물질을 만드는 작용기이다. '술(알코올)'이 물속에서 분해되면 '아세트알데히드(C2H4O)'가 만들어진다. 또 생물 표본을 만들 때 쓰는 '포르말린'도 알데히드의 일종인데, 몸에 해로운 물질이다.
- 술포기(Sulfo Group): 물에 잘 녹고 강한 산성을 나타내는 작용기이다.
- 카르복시기(Carboxy Group): '아세트산(CH3COOH)' 등 유기물 산을 만드는 작용기이다. '알데히드'에서 변화해 생긴다는 사실이 알려져 있다. 예컨대 숙취를 일으키는 '아세트알데히드(C2H4O)'가 분해되면 '아세트산(CH3COOH)'이 된다.
- 에스테르 결합(Ester Linkage): 다양한 향을 만드는 작용기이다. '에스테르 결합'을 가진 작은 분자는 꽃이나 과일 향기의 분자에 많이 존재한다. 또 섬유의 소재인 '폴리에스테르'는 '에스테르 결합'을 많이 가진 분자가 길게 이어진 소재이다.
- 니트로기(Nitro Group): 급격히 반응해 폭발하기도 하는 작용기이다. 화약의 일종인 'TNT 화약(트리니트로톨루엔)'은 니트로기가 여럿 붙어 있다. 니트로기가 많이 붙은 분자는 폭발하는 성질이 있다.
- 아미노기(Amino Group): 수소를 잡아당기고, 알칼리성을 나타내는 작용기이다. 질소는 음전기를 띠고 있는데, 수소 이온 등을 또 하나 잡아당기려고 한다. 이 때문에 아미노기는 '알칼리성'을 나타낸다. 단백질을 만드는 아미노산은 '아미노기'와 '카르복시기'가 붙은 분자'이다.
| 작용기(Functional Group) | 화학식 |
| 히드록시기(Hydroxyl Group) | -OH |
| 에테르 결합(Ether Linkage) | -O- |
| 카르보닐기(Carbonyl Group) | -COH, -CO- |
| 술포기(Sulfo Group) | -SO2(OH) |
| 카르복시기(Carboxy Group) | -COOH |
| 에스테르 결합(Ester Linkage) | -COO- |
| 니트로기(Nitro Group) | -NO2 |
| 아미노기(Amino Group) | -NH2 |
8. 이성질체(isomer)
식품에 포함된 감미료 중에는 '팔라티노오스'라고 불리는 감미료가 있다. '팔라티노오스'는 '설탕'과 원자의 종류와 개수가 같음에도 충치가 잘 생기지 않는다. 그 이유는 설탕과 원자의 종류와 개수가 같아도 원자의 연결 방식이 달라, 성질이 다른 물질이기 때문이다. 이처럼 '유기 화합물'에는 같은 종류의 수의 원자로 이루어져 있지만 연결 방식이 다른 것이 많은데, 이것을 '이성질체(isomer)'라고 한다. 원소의 수가 많은 복잡한 분자일수록 '이성질체'의 수도 많아진다. 이성질체는 분자의 모양이 어떻게 다른가에 따라 '구조 이성질체(Constitutional isomer)'와 '입체 이성질체(Stereoisomer)'로 나눌 수 있다.
8-1. 구조 이성질체
'구조 이성질체(Constitutional isomer)'는 분자식은 동일하지만, 분자내 구성원자들의 연결방식이 다른 화합물이다. 예컨대, '뷰테인(Butane)'과 '메틸프로페인(Methylpropane)'은 둘다 C4H10으로 분자식이 동일하지만 다른 물질이다. 뷰테인의 구조식은 H3C-CH2-CH2-CH3으로 표현되며, 메틸프로페인의 구조식은 'H3C-CH(CH3)CH3로 표현된다. 또 '구조 이성질체'는 주로 '사슬 이성질체', '위치 이성질체', '작용기 이성질체' 등으로 구분한다.
8-2. 입체 이성질체
'입체 이성질체(Stereoisomer)'는 공간 배열이 달라짐에 따라 생기는 이성질체를 말하며, '거울상 이성질체'와 '부분 입체 이성질체'가 존재한다.
- 거울상 이성질체(Optical isomer): '거울상 이성질체'는 분자의 구조가 좌우 대칭인 관계에 있는 분자를 말한다. '광학 이성질체(Optical isomer)'라고 부르기도 한다. '거울상 이성질체'는 모양이 아주 비슷하지만, 다른 성질을 가지고 있다. 예컨대, 박하에 포함된 '멘톨(Menthol)'이라는 분자가 있다. 자연의 박하는 멘톨의 거울상 이성질체의 한쪽만 만드는데, 이것은 박하의 상쾌한 맛을 느끼게 하는 분자로 'L체'라고 한다. 한편, 멘톨을 실험실에서 만들면, 약 2분의 1 확률로 다른 한쪽 분자도 생긴다. 이것은 소독약 냄새를 가진 분자로, 'D체'라고 한다. L체와 D체는 '만드는 방식'이나 '화학 반응의 방식'도 거의 같은데, 실은 다른 물질이다.
- 부분 입체 이성질체: '부분 입체 이성질체'는 거울상 관계가 아닌 입체 이성질체를 말한다. 구성 원자들의 공간적 배열이 다른 '부분 이성질체'와, 사이클로알케인과 알켄 화합물에서 탄소-탄소 결합의 자유롭지 못한 회전 때문에 원자의 공간 배열이 달라 생긴 cis-trans 이성질체로 나눌 수 있다.

9. 탄소의 특징
'탄소(C, 원자번호 6번)'는 다른 원소해 보면, 탄소가 특히 무수히 다양한 종류의 물질을 만든다는 것을 알 수 있다. 그러면 탄소는 왜 다른 원소보다 특히 다양한 물질을 만들까? 그 이유는 탄소가 특히 2가지 강점을 가지고 있기 때문이다.
첫 번째 강점은 4개의 손을 가진 원소 가운데, 탄소가 주기율표에서 가장 높은 위치에 있다는 점이다. 14족에 있는 '규소(Si, 원자번호 14번)', 게르마늄(Ge, 원자번호 32번)', '주석(Sn, 원자번호 50번)', '납(Pb, 원자번호 82번)' 등의 원소는 모두 4개의 손을 가지고 있다. '탄소(C)'와 그 아래에 있는 '납(Pb)'를 비교해 보자. 둘 다 가장 바깥쪽 궤도의 전자로 다른 원자와 결합한다. 하지만 바깥쪽 궤도까지 먼 납 원자에서는, 전자가 더 달아나기 쉽고 결합이 끊어지기 더 쉽다. 하지만 탄소 원자에서는 바깥쪽 궤도까지 가깝기 때문에, 전자를 빼앗기지 않고 결합을 더 단단히 유지한다.
두 번째 강점은 주기율표의 위에서부터 두 번째 단만 보았을 때 탄소가 중간에 있다는 점이다. 탄소의 왼쪽에 있는 '리튬(Li)', 탄소의 오른쪽에 있는 '플루오린(F)'과 비교해 보자. 리튬은 바깥쪽 궤도에 전자를 1개만 가지고 있으므로, 이 전자가 없어지면 안정된다. 반면, 플루오린은 두 번째 궤도에 전자가 7개 있어서 1개의 전자만 더 있으면 안정된다. 그래서 리튬과 플루오린은 1개의 전자를 주고받음으로써 안정된다. 한편, 탄소는 궤도를 채우기 위해서는 4개의 전자를 방출해서 첫 번째 궤도만 차거나, 4개의 전자를 얻어서 두 번째 궤도를 채워야 한다. 하지만 탄소가 4개나 되는 전자를 빼앗거나 방출하기는 매우 어렵다. 그래서 대신 다른 원자와 전자를 공유해서 결합하려는 성질이 강한 것이고, 이 때문에 다양한 결합이 가능해진다.

9-1. 생명은 왜 탄소 기반일까?
주기율표의 14족은, 우리에게 친근한 물질로서 중요한 역할을 하고 있다. 14족의 원소는 '원자가전자'를 4개 가지고 있어서, 4개의 손을 사용해 여러 가지 원자와 결합할 수 있다. 그것에 의해 다양한 물질을 만들거나 여러 가지 결정의 형태를 취할 수 있다. 예컨대 '탄소(C)'는 '산소(O)'와 결합해 '이산화탄소(CO2)'를, 또는 '질소(N)' 등과 결합해 아미노산을 구성할 수 있다. 생명에서 빠뜨릴 수 없는 물질의 대부분은 탄소를 주요 성분으로 하고 있다.
'규소(Si)'도 4개의 손을 사용하여 다른 원자랑 결합한다. 자연계에서는 산소에 이어 두번쨰로 많은 원소이다. 하지만 규소는 생명의 주요한 성분이 아니다. 왜 그럴까? 그 이유 중하나는 '산화물 성질의 차이'라고 한다. 생물은 산소를 들이마시고 탄소의 산화물인 이산화탄소를 방출한다. 하지만 규소의 산화물인 '이산화규소(SiO2)'는 고체이다. 그렇기 때문에 제대로 배출하기가 어렵다고 생각된다. 이러한 성질의 차이로부터, 탄소가 선택되었다고 생각하는 연구자도 있다.
10. 자연계의 유기물
유기물은 다양한 화학 반응에 의해 분자를 바꾸어 간다. 이렇게 해서 유기물의 종류는 무수하게 늘어나게 된다. 자연계에서도 분자가 조금씩 모습을 바꾸어, 전혀 다른 것으로 된 예가 많이 있다. 그 대표적인 예로 '벌꿀'과 '감자', '나무줄기' 을 들 수 있다. '벌꿀'과 '감자', '나무줄기'는 얼핏 보면 서로 전혀 관계가 없는 물질처럼 보이지만, 실은 같은 분자로 되어 있다. '벌꿀'에 포함된 '당 분자'는 '감자'와 '나무줄기'에 포함된 분자와 비슷하다.
- 벌꿀: 벌꿀 안에는 '글루코오스(glucose)'라는 당 분자가 포함되어 있다. 그리고 글루코오스는 '알파 글루코오스(α-glucose)'와 '베타 글루코오스(β-glucose)'라고 불리는 2종류 형태의 분자가 공존하고 있음이 알려져 있다. 두 분자는 얼핏 보면 같아 보이지만, 잘 보면 한 군데의 OH기의 위치가 다른 '입체 이성질체'의 관계에 있다. 이 두 분자를 닮은 형태의 분자가 감자의 녹말이나 나무줄기의 섬유에도 있다.
- 감자: 감자의 '녹말'을 만드는 '아밀로오스(amylose)'는 분자의 긴 사슬이 불규칙하게 소용돌이치는 모양을 하고 있다. '아밀로오스 분자'를 보면, 두 글루코오스 중의 하나인 '알파 글루코오스(α-glucose)'가 길게 이어진 모양을 하고 있다.
- 나무줄기: 나무줄기는 '셀룰로오스(cellulose)'라고 불리는 곧은 분자가 모여서 이루어져 있다. '셀룰로오스' 분자를 보면, '베타 클루코오스(β-glucose)'가 길게 이어진 모습을 하고 있다.
'아밀로오스(Amylose)'와 '셀룰로오스(Cellulose)'의 차이는 '글루코오스 분자의 연결 방식'의 차이에 있다. 이처럼 미세한 차이에서 다양한 유기물이 만들어진다.
11. 인공 유기물
우리의 일상생활에는 '인공 유기물'이 많이 이용되고 있다. '비닐봉지'나 '페트병'이 사용되며, '폴리에스테르'나 '나일론'으로 만들어진 옷들이 만들어지고 있다. 또 '접착제'나 '높은 압력에 견디는 물통의 벽'등 다양한 소재가 만들어지고 있다. 이들은 모두 사슬 모양의 긴 분자인 '고분자(Polymer)'로 되어 있다. '폴리머(Polymer)'는 20세기에 새로 만들어진 새로운 유기물이다. 19세기 초, 화학자들에게 유기물은 '생명이 만들어내는 것'이었지만, 20세기부터는 유기물을 인공적으로 만들 수 있게 되었다.
'폴리머(Polymer)'는 우선 작은 분자 '단위체(Monomer)'를 만들어지고, 그 분자가 수만~수십만 개나 이어져 사슬 모양의 '폴리머(Polymer)'가 된다. '모노(Mono)'는 1을 '폴리(Poly)'는 '많은'이라는 뜻을 가지고 있다. 즉, '폴리머(polymer)'는 '분자를 많이 이은 것'이라는 뜻이다. '폴리머(polymer)'도 설탕이나 식물 등과 같은 '유기물'이다. 하지만 '인공 유기물'은 오랫동안 분해되지 않은 것들이 많다. 그 이유는 자연계에 이들 인공 물질을 분해하는 생물이 존재하지 않기 때문이다. 그래서 자연계에서 분해되는 소재의 개발이나 재활용 기술의 보급도 진전되고 있다.
| 고분자의 이름 | 용도 |
| 폴리에틸렌 | 비닐봉지 |
| 폴리메타크릴산메틸 | 수족관의 수조 벽 |
| 폴리스티렌 | 스티로품 |
| 에폭시 수지 | 접착제 |
| 폴리염화비닐 | 수도관 등 |
| 폴리카보네이트 | CD-ROM |
| 폴리테트라플루오린에틸렌 | 눌러붙지 않는 프라이팬 |
| 폴리이소프렌 | 타이어, 고무 밴드 |
11-1. 고분자가 되는 메커니즘
- 손이 1개 남은 분자가 에틸렌의 이중결합을 풀고 결합한다.
- 손이 1개 남은 분자가 가까운 곳의 에틸렌의 이중결합을 풀고 결합한다.
- 손이 1개 남은 새로운 분자가 다시 가까운 곳의 에틸렌의 이중 결합을 풀고 결합한다.
- 손이 남은 분자끼리 만나면 반응이 끝난다. 반응이 끝날 때까지 수만~수십만 개의 탄소가 결합해서 긴 사슬 모양의 분자가 생긴다.
12. '유기 화학'과 석유
우리는 '석유(원유를 정제해서 만든 제품의 총칭)'를 이용해서 '휘발유', '플라스틱', '나일론 등의 섬유', '아스팔트', '고무' 등의 다양한 물질을 만들어 낸다. 이들은 모두 탄소, 산소, 수소 등으로 이루어진 '유기 화합물'이다. 그러면 왜 석유를 원료로 하는 것일까? 그 이유는 석유가 이산화탄소에 비해 '높은 에너지'를 가지고 있기 때문이다.
그러면 높은 에너지란 무엇일까? 석유의 에너지는 탄소와 탄소의 결합에 저장되어 있다. 예컨대 석유를 태우면 이산화탄소나 물 이외에 열이나 빛도 생긴다. 이때 탄소와 탄소의 결합이 끊어지고 다른 결합으로 바꾸미으로써, 남은 에너지를 열이나 빛으로 방출하는 것이다. 그래서 만약 반대로 이산화탄소나 물에서 플라스틱을 만들려고 하면, 열이나 빛과 같은 큰 에너지를 주어야 한다. '플라스틱 분자'도 '석유'와 같은 정도로 높은 에너지를 가지므로, 이산화탄소에서 플라스틱을 만드려면 큰 에너지가 필요하다. 하지만 원래 높은 에너지를 가진 석유를 원료로 하면, 더욱 적은 에너지로 플라스틱 등을 만들 수 있다.
13. '유기 화학'과 약학
사람들은 수천 년 전부터 여러 가지 약초를 발견하고 이용해 왔다. 그리고 19세기 말에는 약을 얻기 위해 다양한 식물을 재배하게 되었다. 그런데 만약 원하는 성분을 인공적으로 합성할 수 있다면, 더욱 단기간에 약을 만들 수 있다. 그래서 20세기에 들어와서는 유기 화학이 발전함에 따라, 다양한 천연 유기 화합물의 구조가 조사되고, 실험실에서 합성할 수 있게 되었다. 그 대표적인 예로, 진통제인 '아스피린(Aspirin)'이나, 말라리아의 특효약인 '퀴닌(Quinine)'이 있다. 또 인플루엔자의 치료약 '타미플루(Tamiflu)'는 붓순나무 열매에서 추출한 분자를 바꾸어 조합해 만든 것이다. 그 외에도 20세기를 지나는 동안 자연에 존재하는 동안, 자연에 존재하는 물질을 인공적으로 합성하거나, 분자를 바꾸어 조합해 더욱 효과적인 약으로 개량하게 되었다.
20세기의 의학은 생물이 만드는 약의 분자를 조사하고 개량해나가면서 발전해 나갔다. 그리고 최근에는 새로운 약품을 컴퓨터를 이용해 만드는 방법도 발전하고 있다. 예컨대 우선 컴퓨터에서 종래 약품의 정보를 바탕으로, 질병에 듣는 새로운 화합물의 후보를 수백만 종류 만든다. 그리고 유망한 것으로 집약하여 실제로 합성해 시험하는 것이다.
13-1. 천연물 화학
20세기에 들어서 유기 화학이 세계에서 연구되자, 각 지역의 독특한 물질을 연구하는 '천연물 화학(Natural Products Chemistry)'이 발전했다. 그중에는 주변에서 친숙해졌던 음식물이나 생물도 포함되어 있다. '이름 - 작용 - 성질' 순서대로 정리하였다.
- 알리자린 (적색 염료): '꼭두서니(덩굴식물)'에서 나오는 염료로, 1868년에 독일의 '카를 리베르만'과 영국의 '윌리엄 퍼킨'이 합성에 성공하였다.
- 글루탐산나트륨(감칠맛): 다시마 등에 포함되어 '감칠맛'을 낸다. 1908년에 일본의 '이케다' 박사가 다시마에서 발견하였다.
- 우루시올(옻칠): 옻의 주성분으로, 굳으면 매우 단단한 막을 만든다. 1906년에 일본의 '미야마 박사, 마지마 박사가 발견하였다. 현재는 합성도 가능하다.
- 테트로도톡신(독): 복어에 있는 맹독으로, 1964년에 일본의 '히라타' 박사, 쓰다' 박사, '로버트 우드 워드' 박사 등이 분자 구조를 규명하였다. 현재는 합성도 가능하다.