0. 목차
- '희소 금속'이란?
- '희소 금속'이 희소한 이유
- 희소 금속 1 - 알루미늄
- 희소 금속 2 - 리튬
- 희소 금속 3 - 백금
- 희소 금속 4 - 네오디뮴과 디스프로슘
- 희소 금속 5 - 인듐

1. 희소 금속(Rare Metal)
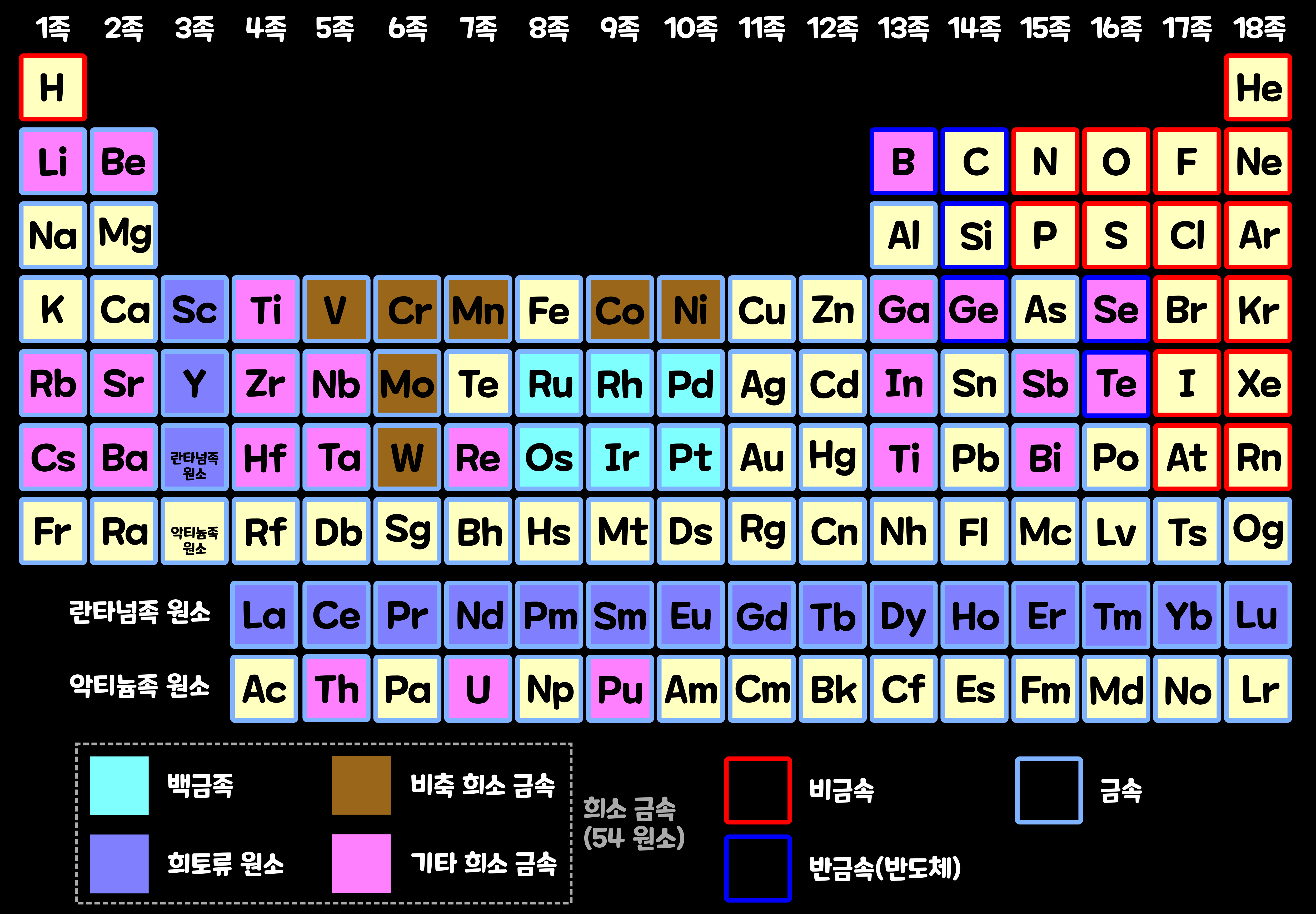
철, 알루미늄, 구리처럼 생산량이 많고 대량으로 사용되고 있는 금속은 '기본 금속'이나 '흔한 금속', '일반 금속', '베이스 금속' 등으로 부른다. 한편, 이들에 비해 희소한 '희소 금속'들도 있다. 원래 '희소 금속(Rare Metal)'은 경제와 산업 분야에서 사용되던 용어였다. 그래서 어떤 것을 희소 금속이라고 하는지도 명확하게 정해져 있지 않고, 희소 금속의 종류도 나라별로 연구자별로 다 다르다. 그리고 희소 금속이 희소한 이유도 희소 금속에 따라 다 다르다. 일반적으로 '희소 금속'으로 54종의 원소가 취급된다. (단, 구체적으로 어떤 것을 희소 금속으로 분류하는지는 연구자나 각 나라의 상황에 따라 조금씩 다름)
그래도 일반적으로 '희소 금속'이라고 부를 수 있는 것은 말 그대로 '지각(두께 30km 정도의 지구 표청)'에 존재량이 매우 적은 원소'이다. 지각 속에 존재하는 희소 금속을 모두 합쳐도 그 양은 대략 0.8%밖에 되지 않는다. 예컨대, '백금족 원소(루테늄, 로듐, 팔라듐, 오스뮴, 이리듐, 백금 등 6원소의 총칭)'나 '인듐(In)', '레늄(Re)' 등을 들 수 있다.
지각 내 부존량이 적거나 추출이 어렵지만 산업적 수요가 큰 '희소 금속'들은 특별히 관리된다. 각국은 자국 산업 특성에 따라 30종 내외의 '희소 금속'을 분류, 선정·관리하고 있다. 대한민국도 2021년 현재, 다음과 같은 희토류(1종)를 포함한 총 35개 원소의 희소 금속을 선정·관리하고 있다. 한국에서는 '망가니즈(Mn)', 코발트(Co)', '바나듐(V)', '인듐(In)', '리튬(Li)', '크롬(Cr)', '몰리브데넘(Mo)' 등을 주요 비축 대상으로 삼고 있다.
'희토류 원소(Rare Earth Elements)'는 '스칸듐(Sc)'과 '이트륨(Y)' 그리고 15개의 '란타넘족'의 원소를 합한 17개 원소의 총칭이다. 주기율표에서 '란타넘족(Lanthanides)'의 아래는' 악티늄족(actinide)'이라고 불리는 원소 그룹이다. 일본 정부의 경우, 악티늄족을 '희소 금속'에 포함시키지 않았다. 하지만 많은 연구자들은 '토륨(Th)'과 '우라늄(U)' '플루토늄(Pu)'도 '희소 금속에 포함시킨다. '우라늄'과 '플루토늄'은 원자력 발전의 연료로 중요하며, '토륨'은 원자력 발전의 연료 후보로 검토되고 있다. 따라서 여기에서는 이들 원소도 '희소 금속'으로 다룰 것이다.
1-1. 첨단 기술 제품의 뒤에 있는 희소 금속들
첨단 기술 제품에는 실로 여러 가지 '희소 금속'이 사용되고 있다. 그래서 희소 금속은 '산업의 생명선'이라고 불리기도 한다. 만약 희소 금속이 사라진다면, 현대 산업은 멈출 것이다. 여기에서는 첨단 기술 제품의 뒤에 숨어있는 희소 금속들에는 어떤 것들이 있는지 알아보자.
- 컴퓨터의 하드 디스크(Nd): 희토류 원소인 '네오디뮴(Nd, 원자번호 60번)'을 포함한 자석은 강력한 모터의 부품이 된다. 그 주요 용도는 컴퓨터의 '하드 디스크(자기를 이용한 데이터 기록 장치)'와, 자동차의 '모터', 의료기기인 'MRI(자기 공명 연상)' 장치 등이 있다.
- 액정 디스플레이(In): 인듐(In)'의 용도로 가장 많이 사용되는 것이 '액정 디스플레이'이다.
- 고효율 태양 전지(In, Ga, Se): '인듐(In)'이나 '갈륨(Ga)', '셀레늄(Se)'을 사용한 태양전지는 높은 발전 효율을 보이는데, 앞으로도 수요가 늘어날 것으로 기대된다. 'CIGS(구리·인듐·갈륨·셀레늄)' 반도체를 쓰고 있어서 'CIGS형 태양 전지'라고 불린다.
- 스마트폰에 쓰이는 희소 금속(Nd, In, Li): 스마트폰에서 착신을 알리는 '진동 기능'에는 '네오디뮴(Nd)' 자석을 사용한 진동 모터가 쓰인다. 또 액정 디스플레이에는 '인듐(In)'이 쓰인다. 또 배터리에는 '리튬 이온 배터리'가 쓰인다. '리튬(Li)'도 희소 금속이다.
- 배출 가스를 내보내는 자동차의 쓰이는 희소 금속(Pd, Pt, Rh): 배출 가스를 내보는 자동차에는 희소 금속인 '백금(Pt)'을 사용한 정화 장치가 붙어 있다. '로듐(Rh)'이나 '팔라듐(Pd)'이라는 희소 금속도 함께 쓰이는 일이 많다.
- 하이브리드차에 쓰이는 희소 금속(Nd, Dy): 하이브리드차의 모터에는 '희토류 원소'인 '디스프로슘(Dy)'을 첨가한 '네오디뮴(Nd)' 자석이 쓰인다. 디스프로슘은 네오디뮴 자석에 내열성을 주기 위해 필요하다.
- 전기 자동차에 쓰이는 희소금속(Li): 전기 자동차의 배터리에도 '리튬(Li)'을 재료로 사용한 '리튬 이온 배터리'가 쓰인다.
- 항공기에 쓰이는 희소 금속(Ti): 항공기의 몸체에는 희소 금속인 '티타늄(Ti)'이 사용된다. 티타늄은 가볍고 잘 녹슬지 않아, 아주 뛰어난 강도를 자랑한다. 티타늄은 지각 중에 풍부하게 존재하기 때문에, 만약 저가로 제조할 수 있다면 '희소 금속'에서 졸업할 수 있게 될 것으로 생각된다.
1-2. 희소 금속이 생산되는 곳은 한정되어 있다.
'희소 금속'은 특히 지리적인 이유 때문에 산출국에 큰 편차를 가지고 있는 것이 특징이다. 예컨대, 2016년 기준으로 '백금(Pt, 원자번호 78번 원소)'은 남아프리카 공화국에서 세계 생산량의 75%, 러시아에서 세계 생산량의 17%가 생산된다. '텅스텐(W, 원자번호 74번 원소)'은 중국과 베트남에서 88%, '네오디뮴(Nd, 원자번호 60번 원소)' 등의 희토류 금속은 중국에서만 93%가 생산된다. 또 '탄탈럼'은 오스트레일리아에서 세계 생산량의 63%가 생산되고, '나이오븀'은 브라질에서 세계 생산량의 88%가 생산된다. (단, '희소 금속'은 수요가 적으면 특정 지역에 있는 광산만으로도 충분해, 희소 금속의 산출에 편차가 생기기도 한다.)
이와 같이 산출국이 한정되어 있으면, 그 나라가 수출을 줄였을 때 희소 금속을 확보하기 어려워지는 상황이 생길 수 있다. 그래서 이러한 희소 금속은 '자원의 고갈'이 문제라기보다는, '공급의 안정'이 문제가 된다. 희소 금속은 수요과 공급의 균형이 무너지면 가격이 크게 오르거나 내린다. 예컨대, 액정 TV의 보급으로 수요가 급격히 늘어난 '인듐(In)'의 가격은 몇 년 사이에 8배 이상 오른 적도 있다. 인듐뿐만 아니라 희소 금속의 가격은 전반적으로 상승하는 경향에 있다. 앞으로 현재 선진국이 아닌 나라들의 생활 수준이 올라가면, 더 많은 수요가 필요해져 '희소 금속'의 가격이 더욱 상승할 것으로 예상된다.
더구나 일반적으로 희소 금속의 광산 개발에는 10년, 20년이라는 오랜 시간이 걸리지만, 수요는 훨씬 짧은 시간에 발생한다. 이러한 이유 때문에 희소 금속은 수요와 공급을 맞추기가 어려운 측면이 있다.
2. '희소 금속'이 희소한 이유
하지만 희소 금속이 반드시 지각 속의 존재량이 적은 것은 아니다. 실제로 '기본 금속'으로 분류되는 금속보다 지각 속의 존재량이 많은 희소 금속도 있다. 그러면 이러한 금속들은 왜 희소 금속으로 분류될까? 여기에는 주로 다음과 같은 두 가지 이유가 있다.
2-1. 채취 효율이 나빠서
첫 번째 이유는 '존재량은 적지 않지만 한데 모아 산출하기 어려운 원소'이다.
- 바나듐의 경우: '바나듐(V, 원자번호 23)'의 경우, 지각 내 존재량이 '230ppm(1톤당 230g)'이다. '희소 금속'이 아닌 '구리(Cu)'의 지각 존재량인 '75ppm(1톤당 75g)'보다 높은 수치이다. 하지만 '바나듐'은 땅속에 넓고 희박하게 존재하여, 입수하기가 어려우므로 '희소 금속'으로 취급하고 있다.
- 백금의 경우: '백금(Pt, 원자번호 78번)'의 경우, 남아프리카 공화국에 거대한 백금 광산이 있다. 이 광산 지대에는 수만 톤이나 되는 매장량이 확인되어 있지만, 문제는 백금의 농도이다. 5g의 백금을 광석에서 추출하려면 1톤이나 되는 광석이 필요하다. '철(Fe)'과 비교해 보면, 이제까지 채굴된 백금 광석은 약 25분의 1이다. 그러나 거기에서 추출된 금속 홑원소 물질로 보면, 백금은 철의 850만 분의 1에 지나지 않는다.
2-2. 채취 비용이 많이 들어서
두 번째 이유는 '존재량은 적지 않지만 광석에서 채취하기 어렵거나 시간이 많이 필요한 원소'이다.
- 티타늄의 경우: 예컨대 '티타늄(Ti)'의 지각 매장은 '5400ppm(1톤당 5400g)'이라고 한다. 이것은 기본 금속인 구리보다도 훨씬 많은, 존재량으로 보면 엄청나게 많은 희소 금속이라고 할 수 있다. 하지만 티타늄을 광석에서 홑원소 금속으로 채취하려면 대량의 전력과 시간이 필요해, 생산성이 매우 나쁘다. 그래서 티타늄은 제조 기술상의 문제로 '희소 금속'으로 분류된다.
- 일루미늄의 경우: '알루미늄(Al)'의 지각 존재량은 '84100ppm(1톤당 84100g)'으로 존재량 자체는 풍부하다. 하지만 과거에는 '알루미늄(Al)'도 '티타늄(Ti)'과 같은 이유로 '희소 금속'으로 취급되었다. 하지만 현재는 알루미늄의 효율적인 제련 방법이 확립되면서 더 이상 '희소 금속'으로 분류되고 있지 않고 있다. '티타늄(Ti)'도 장래에 효율적인 제련 방법이 확립된다면, 더 이상 희소 금속으로 분류되지 않게 될 수도 있다.
3. 희소 금속 1 - 알루미늄
3-1. 과거에 '알루미늄'은 희소 금속이었다.
현재 '알루미늄(Al)'은 우리 생활에서 빼놓을 수 없는 친숙한 '기본 금속'이다. '알루미늄'은 가볍고 가공하기 쉬운 특성을 가지고 있어서, '깡통', '알루미늄 포일', 창틀' 등에 여러 용도로 사용되고 있다. 하지만 과거에 알루미늄은 희소하고 비싼 금속이었다. 19세기 당시만 해도 프랑스의 황제 나폴레옹에게 헌상되었을 정도였다. 하지만 그 후 혁신적인 제련 기술이 확립되어 '기본 금속'이 되었다. '기본 금속'은 오랜 옛날부터 대량으로 사용되어 온 금속으로, 기본 금속에 해당하는 '철', '금', '은', '구리', '아연'등 모두 한자로 나타낼 수 있다. 알루미늄은 한자가 적용되지 않는 것을 보아도 '기본 금속'으로는 '신참'임을 알 수 있다.
과거에 알루미늄이 '희소 금속'이었더 것은 '지각 속의 존재량'이 적기 때문은 아니었다. 알루미늄은 지각 속에 산소, 규소에 이어 풍부하게 존재하며, 금속 원소로는 가장 많다. 그럼에도 불구하고 '희소 금속'이었던 이유는, 천연 상태에서는 거의 화합물 형태로 존재하며, 알루미늄 홑원소 물질을 분리하는 제련 기술이 확립되어 있지 않았기 때문이었다.

3-2. 알루미늄의 유일한 정련법
1807년에 영국의 화학자 '험프리 데이비(Humphry Davy, 1778~1829)'가 '명반(alum)'에서 얻은 금속의 산화물을 '알루미늄(Aluminium)'이라고 이름 붙였다. '명반(Alum)'이란 황산알루미늄과 1가 금속의 황산염이 만드는 '복염(두 가지 이상의 염류가 부가적으로 결합하여 한 개의 결정을 이루고 있는 고차 화합물)'을 말한다. 그리고 1825년에 와서 덴마크의 물리학자 '한스 외르스테드(Hans Christian Oersted, 1777~1851)'가 처음으로 알루미늄의 분리에 성공했다. 그러나 당시에 '알루미늄'은 '매우 귀중한 금속(희소 금속)'이었다.
그러다 1886년에 전환점이 찾아왔다. 미구읭 '찰스 홀(Charles Martin Hall, 1863~1914)'과 프랑스의 '폴 에루(Paul Louis Toussaint Héroult, 1863~1914)'가 각각 독립적으로 알루미늄의 산화물과 빙정석을 이용한 '융해염전해법(fuse salt electrolysis)'을 개발한 것이다. 이 알루미늄의 이 정련법은 '홀-에루법(Hall-Heroult process)'이라 불리며, 현재도 유일하게 실용화되어 있는 알루미늄의 정련법이다.
3-3. '보크사이트'에서 고순도의 알루미늄 산화물을 효율적으로 뽑아낼 수 있게 되었다.
그러나 '알루미늄 정련'에는 또 하나의 중요한 일이 있었다. 알루미늄을 포함한 주요 광석은 '보크사이트(Bauxite)'이다. '보크사이트(Bauxite)'는 '수산화알루미늄' 광물이 모인 광성으로 '철반석'이라고도 불리며, 화학성분은 Al2O3ㆍ2H2O이다. 알루미늄을 분리하려면, 우선 보크사이트에서 알루미늄 산화물을 정제해야 한다. 그리고 1888년에는 오스트리아의 화학자 '카를 바이어(Karl Joseph Bayer, 1847~1904)'가 '보크사이트'에서 고순도의 알루미늄 산화물을 효율적으로 뽑아내는 방법을 개발했다.
하지만 알루미늄의 정련에는 아직 문제가 남아 있었다. 그것은 정련에 많은 전력이 필요하다는 점이다. 그래서 기술은 있어도 대량 생산하기가 어려웠다. 하지만 20세기 중반 이후에 대규모의 발전소가 건설되었고, 마침내 알루미늄의 대량 생산이 가능해졌다. 그 결과, 알루미늄은 정식으로 '기본 금속' 무리에 들어오게 되었다.
4. 희소 금속 2 - 리튬
4-1. 리튬의 수요는 크게 늘어날 예정
'리튬 이온 전지(Lithium-ion Battery)'의 개발이 시작된 것은 1981년의 일이다. 당시 이미 리튬을 사용한 '1차 전지(한 번 쓰고 버리는 전지)'는 보급되어 있었는데, 리튬을 사용한 '2차 전지(충전할 수 있는 전지)'는 아직 개발되지 않았다. '충전이 되는 리튬 이온 전지'를 개발한 사람은 일본의 '요시노 아키라(よしのあきら, 1948~)' 박사이다. '코발트산리튬(LiCoO2)'과 '탄소 섬유'를 조합해 전혀 새로운 전지를 만들어 낸 것이다. 전지가 완성된 것은 1985년이었다.
'리튬 이온 전지'는 세계 여러 나라에서 생산되고 있지만, 그들 나라에서는 전극의 원료가 되는 '탄산 리튬(Li2Co3)'을 수입품으로 의존하는 경우가 많다. '탄산 리튬'의 제조는 1997년에 칠레의 SQM 사가 아타카마 호에서 제조를 시작했다. 값싼 탄산리튬을 팔기 시작했기 때문에, 2000년 경에는 가격이 크게 떨어졌다. 그러다 2000년대 중후반 쯔음에는 전지 재료로서 수요가 증가해 다시 가격이 많이 올랐다. 앞으로는 전기 자동차의 보급으로, 리튬의 소비량이 크게 늘어날 것으로 예상된다.
4-2. 리튬의 생산
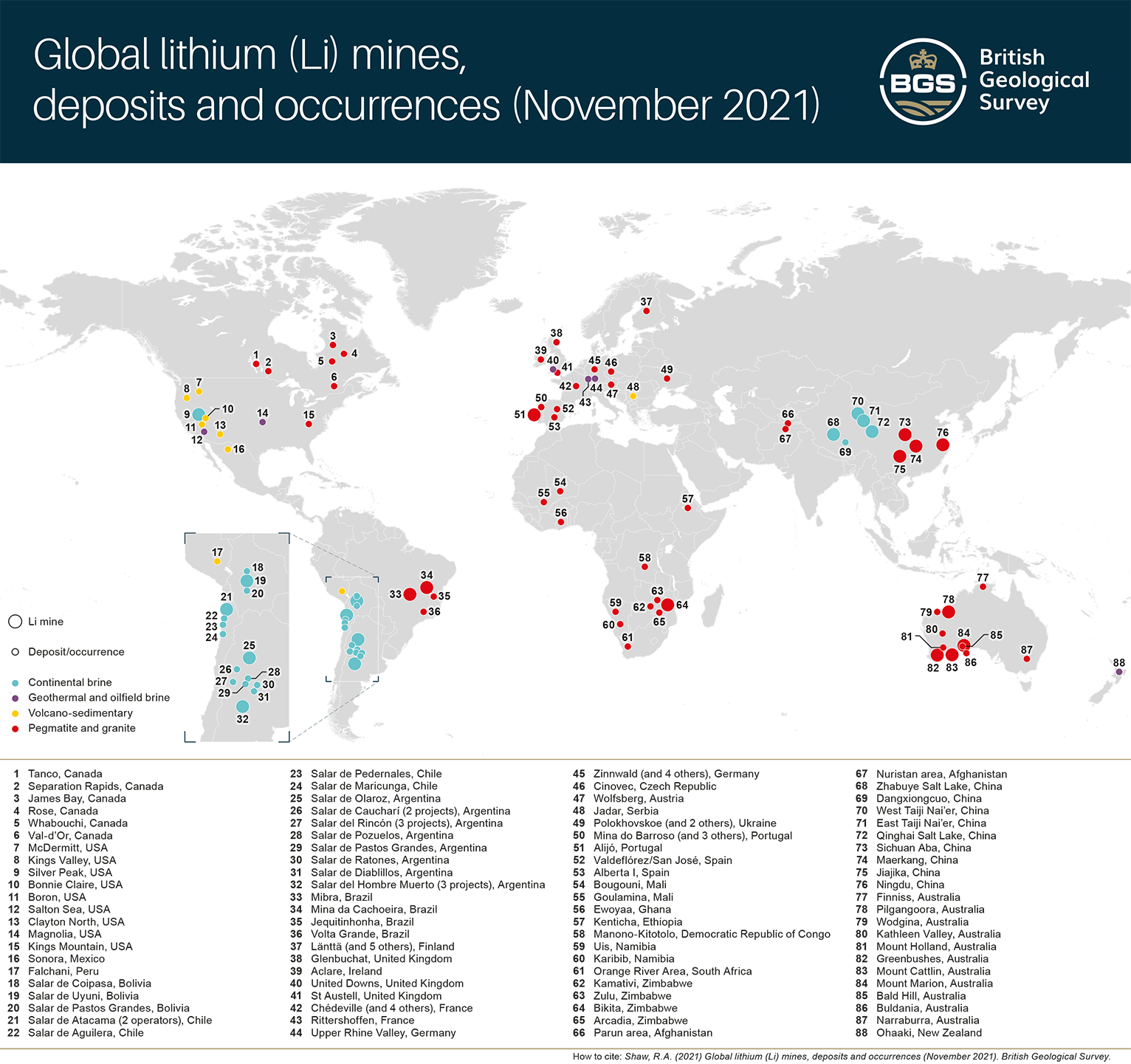
리튬의 주요 생산국은 '칠레', '중국', '아르헨티나'이다. 이들 세 나라에서 주로 '염호(Salt Lake)'에서 리튬을 채취한다. 리튬은 광석에서도 채취가 되지만, 염호에서 채취하는 양이 증가하는 경향이 있다. '염호(Salt Lake)'란 염분 농도가 1L당 0.5g 이상 되는 호수를 말한다. 호수에 들어가는 물의 양보다 증발하는 물의 양이 많아지면, 염분 농도가 높아진다. 지하에는 리튬 농도가 1L당 약 1.0g인 더욱 진한 염수가 있다. 리튬을 채취하기 위해서는 증발시키는 작업 등을 통해서 농축한다. 여기에서 불순물을 제거한 다음, '탄산나트륨(NaCO3)'를 가해서 '탄산리튬(Li2CO3)'을 분리하는 것이 일반적인 방법이다.
리튬은 광석과 바닷물에도 포함되어 있기 때문에, 지구 전체에 존재하는 리튬의 양은 막대하다. 그러나 바닷물의 리튬 농도는 '0.18ppm(1톤당 0.18g)'으로 희박하기 때문에, 현 상태에서는 리튬을 직접 채취하는 일은 이루어지지 않고 있다. 막대한 양 때문에 리튬이 고갈될 일은 없지만, 리튬의 생산은 칠레 및 미국의 세 회사에 의해 거의 독점되고 있다. 그래서 돌발적인 생산 중단이나 가격 상승 등이 문제이다. 그래서 리튬도 '희소 금속'으로 분류되고 있는 것이다.
5. 희소 금속 3 - 백금
5-1. 연료 전지 자동차가 보급되면 '백금'의 수요가 늘어난다.
'백금(Pt, 원자번호 78번)'은 열에 강하고 잘 부식되지 않는 금속으로, 고급 장식품에 쓰인다. 그런데 휘발유 자동차는 백금 1g 정도를 싣고 달린다. 휘발유 자동차의 '배출 가스 정화 장치'에 백금이 쓰이기 때문이다. '배출 가스 정화 장치'에서 '백금'은 '촉매(catalyst)'로 작용한다. '촉매(catalyst)'란 자신은 변하지 않지만 화학 반응을 촉진하는 물질을 말한다.
'배출 가스 정화 장치'를 처음 개발한 것은 영국의 기업이다. 배출 가스가 '광화학 스모그(photochemical smog)' 등의 대기 오염 물질을 만든다는 사실이 밝혀졌고, 미국과 일본이 이어서 자동차의 배출 가스 규제를 강화시켰다. 그 대책으로, 19세기에 촉매로서의 작용이 알려져 있던 '백금(Pt)'이 주목받게 되었다. 현재 일반적으로 쓰이는 '배출 가스 정화 장치'가 완성된 것은 1981년의 일이다. 현재는 많은 나라에서 휘발유 자동차에 '배출 가스 정화 장치'를 장착하는 일은 의무가 되었다.
그런데 사실 '백금'은 수소와 전기를 만드는 '연료 전지'의 전극으로도 사용된다. 따라서 '연료 전지 자동차'의 더욱 보급된다면, 백금 수요는 더욱 늘어날 것이다. 현재 기술로는 '연료 전지 자동차' 1대당 약 40g이나 되는 '백금'을 쓰고 있다. 그래서 백금 용매의 사용량을 줄이거나, 다른 재료로 대체하는 기술 개발도 이루어지고 있다.
5-2. 백금은 생산량은 적고 산출지는 편중되어 있다.
'백금'은 '희소 금속' 중에서도 특히 희소한 금속이다. 지각에 포함된 양은 전체 원소 중에서도 가장 적은 편으로, 지각 1톤당 0.001g이다. '백금'은 '팔라듐(Pd)', '로듐(Rh)' 등 백금과 화학적 성질이 비슷한 원소와 함께 광석에 포함되어 있다. 이렇게 비슷한 원소로는 백금을 포함해 6개가 있는데, 이들을 '백금족(Platinum Metals)'이라고 부른다. '백금족'에 포함되어 있는 6개의 원소는 '백금(Pt)', '팔라듐(Pd)', '로듐(Rh)' 루테늄(Ru), '이리듐(Ir)', '오스뮴(Os)'이다.
백금족을 포함한 광석 채취는 남아프리카 공화국과 러시아가 거의 독점하고 있다. 근년에는 짐바브웨도 생산량이 빠르게 늘어, 미국가 캐나다를 추월했다. 2010년 기준 연간 생산량은 약 500톤 정도인데, 대략 백금이 200톤, 팔라듐이 200톤, 기타 100톤이다. 참고로 '금(Au)'의 전 세계 생산량은 약 2000톤이다.
5-3. 백금의 대체 기술
5-3-1. 카본 알로이 촉매(CAC)
일본 도쿄 공업대학의 '가키모토 마사아키' 교수와 '나바에 유타' 조교수 등은 '호쿠리쿠 첨단 대학', '도쿄 대학', '쓰쿠바 대학' 및 기업 4개사와 공동으로 '카본 알로이 촉매(CAC: Carbon Alloy& Catalyst)'를 개발하였다. (Carbon은 '탄소'라는 뜻이고, Alloy는 '합금'이라는 뜻임) 이것은 'NEDO(일본 신에너지 산업 기술 종합개발 기구)'가 2010년 4월부터 추진한 '희소 금속 대체 재료 개발 프로젝트'중 하나이다.
'휘발유 자동차'의 경우 몇 g의 백금이 배출 가스를 정화하기 위해 쓰이고, '연료 전지 자동차'의 경우 '연료 전지'의 전극에 '백금 촉매'를 필요로 한다. 하지만 '백금(Pt)'는 희소 원소이기 때문에, 이는 '연료 전지 자동차'의 보급에 걸림돌이 된다. 그래서 '가키모토 마사아키' 교수와 '나바에 유타' 조교수 등은 '탄소 촉매(Carbon Catalyst)'에 주목하였다. 숯은 주성분이 '탄소(C)'인데, 숯이 촉매로 작용한다는 사실은 1920년대부터 알려져 있다. 또 좋은 숯에는 웬일인지 '질소(N)'가 많이 포함되어 있다는 사실도 알려져 있었다.
'카본 알로이 촉매(CAC: Carbon Alloy Catalyst)'는 탄소 원자가 육각형을 만드는 것처럼 늘어선 구조를 하고 있다. '가키모토 마사아키' 교수 등에 따르면, 탄소와 교대로 질소가 들어가면, 그 질소의 양쪽 옆의 탄소가 촉매로 작용하게 된다고 한다. 될 수 있는 대로 많은 질소를 넣을 수만 있다면, 높은 효율로 촉매 반응을 일으킬 수 있을 것으로 보인다. 일반적인 숯은 목재를 구워서 만든다. 마찬가지로 '카본 알로이 촉매(CAC)'도 마찬가지로 '폴리이미드(탄소와 질소의 고분자 화합물)'를 구워서 만든다. 단, 이때의 온도가 지나치게 낮거나 높으면, 이상적인 입체 구조를 만들 수 없다. 그래서 '카본 알로이'를 만드는 최선의 방법에 대해서 시행착오를 겪으며 연구하고 있다.
6. 희소 금속 4 - 네오디뮴과 디스프로슘
6-1. 희토류 원소의 생산은 중국이 거의 독점 중이다.
'네오디뮴(Nd, 원자번호 60번)'과 '디스프로슘(Dy, 원자번호 66번)'은 모두 '희토류 원소'이다. '네오디뮴(Nd)'이나 '디스프로슘(DY)'은 화학적인 성질이 비슷한 다른 희토류 원소와 섞여서 같은 광물에 포함되어 있다. 그래서 희토류 원소는 하나하나의 원소를 분리하지 않고, 서로 썩인 광물 그대로 유통되는 경우도 많다. '네오디뮴 자석(Neodymium Magnet)'을 생산하는데 필요한 재료인 '네오디뮴(Nd)'이나 '디스프로슘(Dy)'은 대부분 중국 등지에서 수출되고 있다. 2009년에는 세계에서 약 12만 4000톤의 희토류 원소가 생산되었는데, 그 가운데 약 97%를 중국이 차지했다.
하지만 실재 중국의 '희토류 원소의 매장량은' 약 37% 정도밖에 되지 않는다. 실제로 '희토류 원소 광산'은 전 세계에 존재한다. 아래의 표는 2010년 기준 전 세계의 '희토류 매장량'을 나타낸 것으로 총량은 약 9900만 톤이다. 중국과 러시아가 절반 이상을 차지하고 있다. 또 지각의 존재량은 '백금족'보다 많은데, 지각 1톤당 0.3~33g정도이다. 하지만 중국산 희토류 원소의 가격이 낮기 때문에, 다른 나라는 경쟁을 하지 못하는 것이 현재의 상황이다. 생산지가 한정되어 있으면, 돌발적인 수출 중단이나 가격 급등의 영향을 받는다. 또 중국은 수출량을 계속 줄이고 있다. 그래서 지금은 '새로운 광산의 탐색'이 진행되거나, '사용이 끝난 제품에서 희토류 원소를 회수하는 기술', '희토류 원소를 쓰지도 않아도 되는 대체 기술'의 개발이 추진되고 있다.
| 국가 | 매장량(%) |
| 중국 | 약 37% |
| 러시아 등 | 약 19% |
| 미국 | 약 13% |
| 오스트레일리아 | 약 5% |
| 인도 | 약 3% |
| 브라질 | 약 0.05% |
| 말레이시아 | 약 0.03% |
7. 희소 금속 5 - 인듐
7-1. 인듐은 부산물이어서 단독으로는 증산되지 않는다.
'인듐(In)'은 단독으로는 광상을 형성하지 않는다. '아연(Zn)'이나 '주석(Sn)', '납(Pb)'의 광석에 극히 소량 포함되어 있으므로, 그들을 꺼내고 난 '나머지'에서 '인듐'을 꺼낸다. 결국 '인듐'은 '부산물'이다. 인듐은 '부산물'이므로 단독으로 증산할 수 없다. 그래서 주산물인 '아연'이나 '납'의 생산량이나 가격에 좌우될 우려가 있다.
매장량에 대해서 불분명한 점이 많고 연구자나 연구 기관에 따라 수치가 다를 수 있지만, '인듐(In)'의 약 75%는 중국에 매장되어 있다고 알려져 있다. 또 인듐은 지각 1톤당 0.05g밖에 존재하지 않는다. 본질적으로 매장량 자체가 희소한 금속이다. 바로 고갈될 걱정은 거의 없다고 생각되지만, 장래를 대비해서 인듐을 대신할 재료의 개발이 이어지고 있다.
7-2. 액정 디스플레이에 사용된다.
원래 '투명하다는 것'과 '전기를 통한다'는 것은 일반적으로 양립하지 않는다. 예컨대 보통 유리는 투명하지만 전기를 통하지 않으며, 금속은 전기를 통하지만 투명하지 않다. '투명한 전극'은 1954년에 독일의 '게오르크 루프레히트' 박사가 개발하였다. 투명한 '산화인듐'이라는 화합물에 5~10%의 주석을 가해서 전기를 통하게 하는 데 성공하였다. '이 인듐과 주석의 화합물(In2O3+SnO2)'을 '인듐 주석 산화물(ITO: Indium Tin Oxide)'이라고 한다.
- 인듐만으로 된 금속(In): '인듐(In)'만으로 된 금속에는 전기가 흐른다. 그러나 투명하지는 않다.
- 인듐의 산화물(In2O3): 산소가 솎아지지 않은 '인듐 산화물(In2O3)'은 투명하지만, 전기는 흐르지 않는다.
- 인듐과 주석의 산화물(In2O3+SnO2): 투명한 '산화인듐(In2O3)'에 주석을 섞거나 산소를 솎아 내면 전자가 남는다. 그리고 전자가 여분으로 남으면, 인듐의 전자구름이 크게 퍼진다. 그래서 전자구름끼리 겹치게 되어, 산소 원자가 사이에 있어도 방해되지 않고 전자가 자유롭게 흐른다. 즉, 투명하면서 전기가 흐른다.
투명하면서 전기가 흐르는 ITO의 '투명한 전극'은 거의 모든 액정 플레이에서 쓰인다. 디스플레이에서 발광하는 층의 바로 앞에 전극이 놓이는 구조가 되기 때문이다. 빛을 발하는 '백라이트(Back Light)'와 빛의 착색하는 '컬러 필터(Color Filter)' 사이에 '투명 전극'으로 된 '액정(Liquid Crystal)'의 층이 있다. 세계적으로 액정 디스플레이'의 수요는 계속 늘어나고 있다. 또 현재 주류인 '실리콘 소재의 태양 전지'보다 발전 효율이 높은 'CIGS형 태양 전지'의 소재로도 쓰인다. 이러한 이유로 장래에 '인듐(In)'은 장래에 더욱 수요가 늘어날 것으로 생각된다.
7-3. 인듐의 대체 기술
7-3-1. 투명하고 전기가 통하는 '마그네슘 액정'
일본 '도카이 대학(Tokai University)'의 '도시로 구지(Toshiro Kuji)' 교수, '마사후미 지바(Masafumi Chiba)' 부교수 등은 마그네슘, 탄소, 수소, 산소 등 흔한 원소만으로 전기를 흐르게 하는 투명한 소재를 개발했다고 발표했다. 희소 금속이 아니면 불가능했던 '투명하고 전기가 통하는 성질'은 어떻게 실현되었을까?
'전기가 흐른다'는 것은 물질 속을 '전자(Electron)' 등의 '전기 담당자'가 이동하는 상태를 말한다. '전기 담당자'가 물질 속에 많이 있을수록 전기는 잘 흐른다. 하지만 '전기 담당자'는 빛을 받으면 빛을 포착해 흡수해 버린다. 그래서 전기를 통하는 물질은 빛을 통하지 못하게 해야 하며, 투명해서는 안 된다. 이번에 개발된 신소재는 '수산화마그네슘'의 결정 가운데 수소의 일부가 탄소로 치환된 구조임이 알려졌다. '수산화마그네슘[Mg(OH)2]'은 매우 투명도가 높은 '절연체(전기를 흐르지 못하게 하는 물질)'이다. 한편, 연필심에 사용되는 '탄소'는 일반적으로 매우 검고 훌륭한 '도체(전기를 흐르게 하는 물질)'이다. '구지 도시로' 교수 등은 '투명하다'는 것과 '전기를 통한다'는 모순된 성질을 이들 소재에 따로 담당시켰다. 그리고 '두 소재(탄소와 마그네슘)'를 원자 수준에서 혼합함으로써, 투명하면서도 전기가 통하는 재료를 발명했다.
'구지 도시로' 교수 등은 원래 '수산화마그네슘'이 아니라 '마그네슘(Mg)'과 '탄소(C)'를 혼합하는 연구를 진행하고 있었다. '마그네슘(Mg)'과 '탄소(C)'는 물과 기름처럼 서로 가까이 있으면 불안정해지기 때문에, 원자 수준에서 혼합하기는 매우 어렵다고 한다. 그래서 이 두 종류의 원자에 강한 에너지를 가해 휘날리게 해 유리창에 부착시켰다. 그러자 두 종류의 원자가 균일하게 섞인 검은 막이 완성되었다. 하지만 이 막은 15분 정도 만에 투명하게 변해 버렸다. 실은 이때 공기 중의 수증기와 마그네슘이 반응해, 수산화마그네슘의 결정으로 변한 것이다. 한편, 탄소는 '수산화마그네슘'의 결정 속에 남았다. 이리하여, 투명하고 전기를 통하는 소재가 발견되었다.
이 소재는 거의 '인듐 주석 산화물(ITO: Indium Tin Oxid)'와 같은 투명도를 갖지만, 아직 통하게 하는 전기의 양은 한 자릿수 정도 적다고 한다. 결정 속의 탄소 위치를 제어해 더욱 전기를 흐르게 하는 소재로 만드는 것이 목표이다.
7-3-2. 알루미나 시멘트 (C12A7)
시멘트의 일종인 '알루미나 시멘트(Illumina Cement)'는 '산화알루미늄(Al2O3)'과 '산화칼슘(CaO)'이 주성분이다. '알루미나 시멘트'는 12CaO·7Al2O3로 나타낼 수 있기 때문에 'C12A7'이라고 불린다. 이 시멘트는 빨리 굳고 '내화성(불에 타지 않고 잘 견디는 성질)'이 뛰어나다. 가루를 굳히면 투명하고 전기를 통하지 않는 '절연체'가 된다. '인듐 주석 산화물(ITO: Indium Tin Oxid)'는 액정 디스플레이에 반드시 필요하며, 재료에 희소 금속인 '인듐(In)'을 사용한다. 그런데 '일루미나 시멘트(C12A7)'가 ITO의 대체 재료가 될 가능성이 있다고 한다.
'일루미나 시멘트(C12A7)'의 특징은 두 가지이다. 하나는 안지름이 0.44nm의 '바구니'가 이어진 분자 구조를 하고 있다는 점이다. 또 하나는 이 바구니가 양전하를 띠고 있다는 점이다. 바구니 구조를 한 물질을 많지만 양전하를 띤 것은 거의 없다.
바구니 6개 중 1개에는 내부에 '산소 이온'이 들어 있다. 일본 도쿄 공업대학의 '호소노 히데오' 교수는 이 '산소 이온'을 '전자(Electron)'로 바꾸면 시멘트에 전류가 흐른다고 생각했다. 산소 이온은 티타늄과 결합하기 쉬운 성질이 있다. 그래서 '호소노 히데오' 교수는 타티타늄을 사용한 제조법을 개발해, 바구니 안에서 '산소 이온'을 밀어내고 '전자(Electron)'로 교체시켰다. 이렇게 해서 만들어진 새로운 C12A7에는 실제로 전기가 흘렀으며, 전기가 흐르는 방식은 금속과 거의 같았다. 이로써 흔한 원소이면서 '투명하고 전기가 흐르는 획기적인 재료'가 탄생했다.
다만, C12A7은 '인듐 주석 산화물(ITO: Indium Tin Oxid)'에 비하면 '전기 전도율'이 한 자릿수 정도 적다는 결점이 있다. 그래서 C12A7이 ITO의 대체 재료가 되려면 '전기 전도율'을 높여야만 한다. 그러기 위해서는 바구니의 구조를 바꿔야 한다. 현 상황에서는 '바구니'가 있음으로써 전자가 자유롭게 움직이기 어렵게 되어 있다. 하지만 재료에 포함되는 원소의 배합 등을 연구하여 바구니의 구조를 개량하면, 전기 전도율이 향상되고 ITO의 대체 재료가 될 가능성이 높아진다.