C형 감염(Hepatitis C)
1980년대까지는 사망자의 대부분에서 '간암(Liver Cancer)'의 원인 질환을 알 수 없었다. 그러나 1989년 'C형 간염 바이러스(Hepatitis C Virus)'가 발견되고, 그 후 바이러스의 유무를 조사할 수 있게 되자, 많은 사람이 'C형 간염(Hepatitis C)'에 걸려 결국에는 간암으로 사망한다는 사실이 밝혀졌다.
0. 목차
- C형 간염은 수십 년에 걸쳐 증상이 나타나지 않은 채 진행된다.
- 바이러스는 세포 기관을 도용해 증식한다.
- C형 간염 치료법
- '바이러스 제거'가 치료의 목표는 아니다.

1. C형 간염은 수십 년에 걸쳐 증상이 나타나지 않은 채 진행된다.
인간은 원래 몸속에 침입한 병원체를 물리치는 시스템인 '면역 시스템(Immune Systme)'을 가지고 있다. 'C형 간염 바이러스(HCV: Hepatitis C virus)'에 간염되면, 약 30%는 무증상 상태에서 면역에 의해 자연 치유된다. 나머지 약 70%는 치료되지 않고 '만성 간염'으로 진행된다.
'만성 간염'이 진행되면 종횡으로 흐르고 있는 혈관의 구조가 무너져 간 기능이 저하된다. 또 '만성 간염'은 간세포가 면역 세포에 의해 파괴되고 재생되기를 반복하면서, '콜라겐(Collagen)' 등이 과도하게 만들어져 결합해 간이 수축되어 딱딱해지는 '섬유화'가 진행된다. 이 과정은 수십 년에 걸쳐 진행되는 '섬유화'가 진행되어 '간경변'으로 발전한다. C형 간염의 무서운 점은 '간경변(Liver Cirrhosis)'으로 진행되는 과정에서 자각 증상이 거의 없음에도 불구하고 간암에 걸릴 위험성이 높아진다는 것이다. 간암에 걸리고 나서 처음으로 C형 간염 바이러스에 감염되었다는 사실을 아는 경우도 있다.
C형 간염의 감염은 약 50%가 병원에서 수혈 등을 통해 발생했다고 생각된다. C형 간염 바이러스가 발견되지 않았던 시대에 증상이 아직 발현되지 않은 감염자가 헌혈을 하고, 그 혈액을 치료에 사용한 것이다. 또 제2차 세계 대전 혼란기에는 각성제를 맞을 때 주사기를 돌려 쓴 점도 감염을 확산시킨 원인이라 생각된다.
2. 바이러스는 세포 기관을 도용해 증식한다.
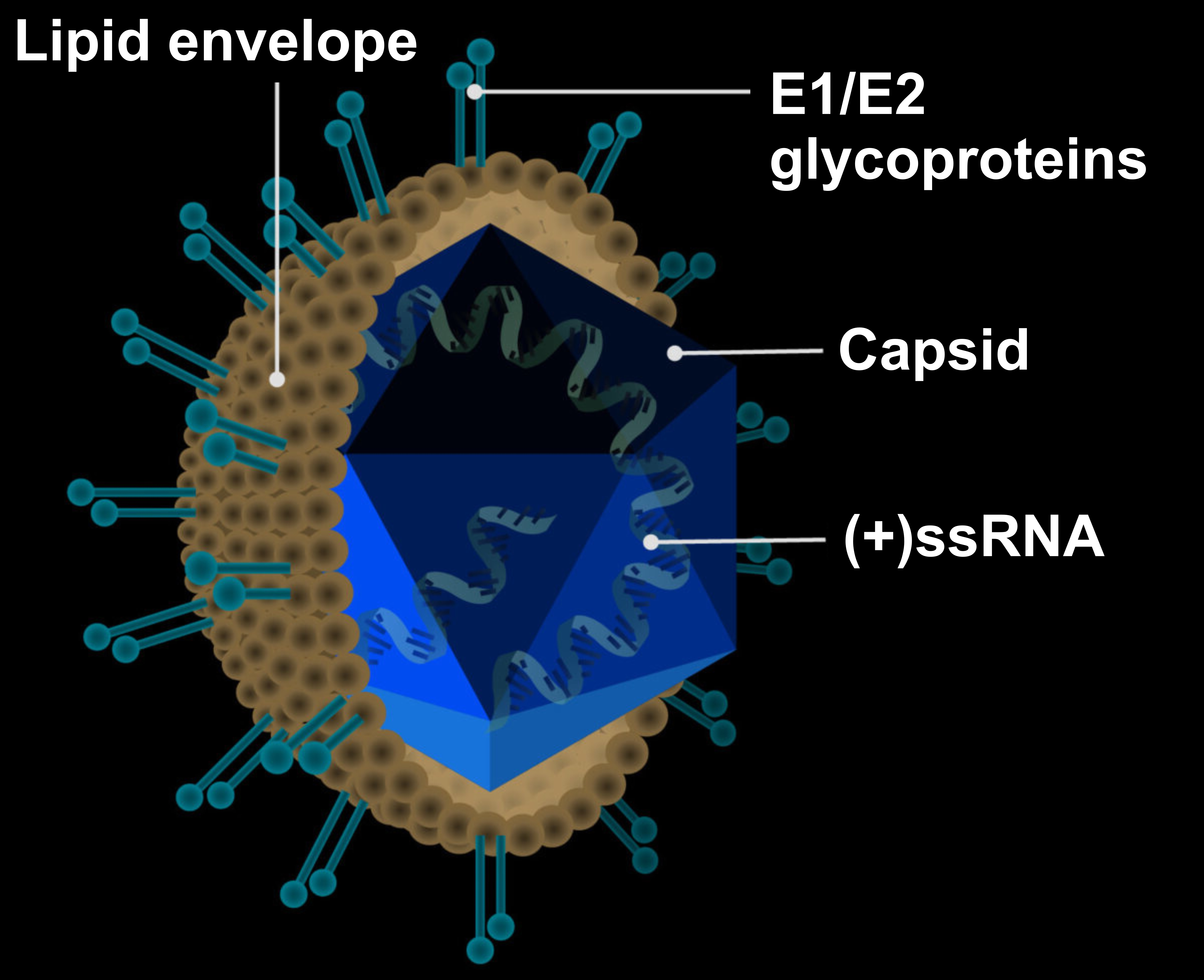
'C형 간염 바이러스(HCV: Hepatitis C virus)'는 유전 정보를 기록한 'RNA(Ribonucleic Acid)'와 RNA를 둘러싸고 있는 단백질 막인 '캡시드(Capsid)', 또 그것을 둘러싼 지질막인 '엔벨로프(Envelope)', 그리고 엔벨로프에서 튀어나온 돌기 모양의 분자 '스파이크(Spike)'로 이루어진다. 바이러스는 세포와 공통된 재료로 이루어져 있지만, 세포에 비해 매우 작고 단순한 구조이다. 또 인간의 세포는 영양을 공급하면 단독으로 증식할 수 있지만, 바이러스는 단독으로 증식할 수 없다. 따라서 바이러스는 세포 안에 들어가 세포 기간과 재료를 도용해야 비로소 증식할 수 있다. C형 간염 바이러스가 증식하는 구조는 다음과 같다.
2-1. C형 간염 바이러스가 증식하는 구조
- 간세포의 표면에 흡착·침입: 바이러스가 세포 표면의 수용체에 달라붙으면 세포막으로 둘러싸이면서 안으로 침입한다. 이는 세포가 외부에서 물질을 안으로 끌어들일 때의 메커니즘인 '엔도시토시스(Endocytosis)'를 이용한다.
- RNA를 방출: 바이러스의 엔벨로프와 세포막이 융합되어 구멍이 열리고 바이러스의 RNA가 세포 안으로 방출된다.
- 단백질을 합성: 바이러스 RNA가 가진 유전 정보를 바탕으로 세포의 '리보솜(Ribosome)'dl라는 기관에서 아미노산이 서로 연결되어 하나의 거대한 '다단백질(Polyprotein)'이 합성된다. 그 후, 다단백질은 세포에서 온 단백질 등에 의해 특정 장소에서 절단된다. 절단된 단백질은 새로운 바이러스의 부품이나 RNA를 복제할 때 효소가 된다.
- RNA를 복제: 만들어진 단백질의 일부가 세포의 '소포체'라는 기관의 막으로 들어간다. 단백질이 정해진 배열이 되면 막이 움푹파여서 바이러스의 RNA가 복제된다.
- 바이러스의 조립: '만들어진 바이러스의 단백질'과 '복제된 RNA'가 모여, 새로운 바이러스가 만들어진다. 바이러스는 '세포 내 수송' 시스템에 의해 소포체에서 골지체로 운반된다.
- 표면을 가공: 골지체의 내부를 이동할 때 표면에 당 분자를 결합시키는 등 과정을 거쳐 바이러스가 성숙된다.
- 세포 밖으로 방출: 골지체 막으로 둘러싸이면서 바이러스가 골지체 밖으로 나온다. 세포막과 골지체의 막이 결합해 구멍이 열리면 바이러스가 세포 밖으로 방출된다.
- 다른 세포로 침입: 세포 밖으로 나간 바이러스는 또 다른 세포에 침입한다.
그러면 RNA는 어떻게 복제될까? RNA에는 '아데닌(A)', '우라실(U)', '구아닌(G)', '시토신(C)'이라는 4종의 염기가 있다. '아데닌(A)'은 '우라실(U)', '구아닌(G)'은 '시토신(C)'과 서로 마주하고 결합하는 성질이 있다. RNA 합성을 하는 'NS5B 단백질' 등이 주변에 흩어져 있는 4종의 염기 중 복제할 RNA의 염기에 대응하는 염기만을 결합시킴으로써 새로운 RNA가 만들어진다. 이 새로운 RNA를 토대로 다시 한번 RNA가 합성되면, 바이러스의 RNA와 같은 것이 복제된다.
3. C형 간염 치료법
C형 간염 치료의 첫 단계는 바이러스를 제거해서 '만성 간염'이나 '간경변'의 진행을 막는 것이다. 바이러스 발견 후 다양한 치료법이 탄생했다. 바이러스를 치료할 수 있는 비율은 1990년대에는 몇 %, 2000년대에는 수십 %, 그리고 2011년 이후에는 80% 이상으로 계속 상승했다.
C형 간염의 약의 종류에는 '인터페론(Interferon)', '단백질 저해제(Protein Inhibitor)', '핵산 유사체(Aucleic Acid Analog)'가 있다.
- 인터페론(Interferon): 바이러스의 단백질과 RNA의 합성을 억제하는 효소를 세포에 합성시킨다.
- 단백질 저해제(Protein Inhibitor): 바이러스의 단백질에 붙어 그 작용을 방해한다.
- 핵산 유사체(Aucleic Acid Analog): 바이러스의 RNA가 합성될 때 가짜 염기를 흡수시켜 합성을 중지한다.
3-1. 인터페론
1992년에 '인터페론(Interferon)'을 투여하는 치료법이 먼저 등장했다. 인간의 세포는 바이러스에 감염되면 '인터페론(interferon)'이라는 단백질을 방출한다. 인터페론을 받은 근처의 세포는 '바이러스의 RNA와 단백질의 합성을 중지시키는 효소'를 만들어 바이러스의 증식을 억제하려고 한다. '인터페론'에 의한 치료는 인공으로 만든 인터페론을 투여함으로써, 효소 합성을 촉진하고 바이러스의 증식을 억제하는 방법이다.
'C형 간염 바이러스'는 부분적인 유전자 차이에 따라 1형에서 6형까지 6종으로 나누어진다. 하지만 인터페론에 의한 치료는 1형에는 효과가 별로 없고, 2형에는 효과를 보인다는 특징이 있다. 또 혈액 속의 바이러스의 양이 적을수록 잘 듣는다. 투여 중인 환자 대부분에게 발열, 두통, 근육통 등 다양한 부작용이 나타나기 때문에 치료를 중단하는 경우가 많다는 문제도 있다. '리바비린(Ribavirin)'이라는 약과 함께 사용하는 요법이 오랫동안 사용되었지만, 강한 부작용 때문에 고령의 감염자에게는 사용하기 어렵다고 한다. 이러한 특징 때문에 인터페론 치료를 받을 수 있는 케이스는 한정되어 있었다.
3-2. 단백질 저해제
2011년 무렵부터 등장한 '단백질 저해제(Protein Inhibitor)'는 바이러스 단백질의 '요철(오목함과 볼록함)'에 삽입되어 작용을 방해함으로써 바이러스의 합성을 멈춘다. 예를 들어 '텔라프레비르(Telaprevir)'는 '다단백질(Polyprotein)'을 절단하는 역할을 하는 바이러스의 단백질을 방해하는 약이다.
또 바이러스 중에는 '단백질 저해제'가 단백질의 요철에 잘 삽입되지 않는 경우가 있다. 그런 바이러스를 '내성 바이러스'라고 한다. '단백질 저해제'는 그 약품에 대한 내성 바이러스가 많은 환자에게 사용하면 바이러스를 제거하지 못할 수 있다. 이 경우 내성 바이러스가 많이 살아남기 때문에 향후 유사한 단백질 저해제를 포함한 다른 병용 요법이 효력이 없을 수 있다는 문제가 있다.
3-3. 핵산 유사체
'핵산 유사체(Aucleic Acid Analog)'는 핵염기 종류가 달라졌거나 핵산 골격이 달라진 핵산이다. 바이러스의 RNA가 합성될 때 가짜 염기를 흡수시켜 합성을 중지한다.
핵산 아날로그 약 '소포스부비르(Sofosbuvir)'는 간세포에 들어가면 분자의 구조가 바뀌어 '가짜 우라실'로 기능하게 된다. 바이러스의 RNA 합성을 관할하는 'NS5B 단백질'은 '진짜 우라실'과 '가짜 우라실(소포스부비르)'을 구별할 수 없다. 합성 중인 RNA에 우라실이 들어가야 할 때 '가짜 우라실'이 들어가면 RNA의 합성은 그 이상 진행되지 않늗나. 소포스부비르는 RNAfk는 사슬 모양의 분자의 합성을 중지시키기 때문에 '체인 터미네이터'라고도 불린다. 단, 인간의 RNA 합성에 관여하는 단백질은 '가짜 우라실'과 '진짜 우라실'을 구별할 수 있다. 따라서 소포스부비르는 세포의 RNA 합성을 막을 수는 없다.
3-4. 약품 병용 요법
또 '인터페론(Interferon)'과 '단백질 저해제(Protein Inhibitor)'를 조합한 다양한 '약품 병용 요법'도 등장했다. 이를 통해 치료할 수 잇는 유전자형이나 환자의 연령 범위가 넓어져 '제거율'도 향상되고 있다. 그러나 '바이러스의 유전자형', '약품 내성의 유무', '환자의 연령', '복용하고 있는 다른 약물과 병용' 등 조건을 고려하면 효과가 높은 치료법이 없는 환자도 아직 많다.
예컨대 '소포스부비르(Sofosbuvir)'는 2형 C형 간염에 대해 '리바비린(Ribavirin)'이라는 약과 병용하는 치료법이 있다. 2형에서는 처음으로 인터페론을 사용하지 않는 병용 요법이다. '소포스부비르'는 중대한 부작용이 없으며 약의 병용 제한도 적다. 또 지금까지 소포스부비르의 약품 내성 바이러스는 나타나지 않았다. 이 때문에 기존의 인터페론 치료를 받지 못했거나, 그 부작용으로 치료를 포기했던 환자도 치료를 받을 수 있을 것으로 기대된다.
4. '바이러스 제거'가 치료의 목표는 아니다.
잇따른 신약의 등장으로 바이러스 제거율은 100%에 가까워지고 있다. 그러나 바이러스를 제거했을 뿐 C형 간염의 치료가 끝나는 것은 아니다. 간은 1mm 정도 크기의 '간소엽(Hepatic Lobule)'이라는 구조가 모여서 이루어진다. C형 간염 바이러스에 감염된 상태가 계속되면, 간세포가 파괴·재생되는 과정에서 '콜라겐(Collagen)' 등이 세포 주위에 과도하게 만들어져 결합해 '섬유화(Fibrosis)'된다. 섬유화가 진행될수록 유전자 이상이 축적되어 간암에 걸릴 위험이 증가한다. 바이러스를 제거하면 간염의 진행은 멈춘다. 하지만 그때까지 축적된 세포 속의 유전자 이상은 남아 있다. 즉, 간암에 걸릴 위험성은 여전히 높은 상태인 것이다. 섬유는 바이러스가 제거된 후 몇 년에 걸쳐 천천히 감소되고, 그에 따라 간암이 걸릴 위험성도 낮아진다. 바이러스를 제거해도 즉시 간암의 위험성이 없어지는 것이 아니기 때문에, 바이러스 제거 후에도 정기적으로 검사를 받는 등 자기 관리를 계속하는 것이 중요하다.