에피게놈 편집(Epigenome Editing)
우리의 몸은 '신경 세포(Neuron), '근육 세포', '피부 세포' 등 수백 종 이상의 세포로 이루어져 있다. 하지만 각 세포에 있는 '유전 정보(Genome)'은 모두 같다. 어떤 세포든 그 근원은 '수정란'이라는 단 하나의 세포에서 분열을 거듭해 만들어졌지만, 이 분열 과정에서 유전자 정보가 바뀌는 일은 기본적으로 없기 때문이다. 우리는 살아가면서 몸은 끊임없이 변하지만, 기본적으로 '게놈(Genome)'은 바뀌지 않는다.
이처럼 같은 게놈을 사용해 다양한 세포를 만들어 복잡한 생명 활동을 영위할 수 있는 이유는 세포별로 '작용하는 유전자의 종류와 양'이 다르기 때문이다. 어떤 세포에서는 유전자 A의 스위치가 켜져 있어도 다른 세포에서는 유전자 A의 스위치가 꺼져 있는 on/off 조절이 이루어지고 있다. 사람에게는 2만 개 이상의 유전자가 있어, 각각의 on/off의 조합은 천문학적인 수에 이르지만, 세포는 유전자의 on/off를 절묘하게 조절하면서, 필요한 유전자가 필요할 때 필요한만큼 기능토록 한다. 유전자의 on/off를 조절하는 것이 바로 '에피게놈(Epigenome, 후성유전체)'이다. 그래서 우선 '에피게놈(Epigenome)'의 메커니즘에 대해 알아본 다음, 목표 유전자의 on/off를 마음대로 바꾸는 '에피게놈 편집(Epigenome Editing)' 기술에 대해서도 알아보자. 그리고 '에피게놈 편집(Epigenome Editing)' 기술의 다양한 응용에 대해서도 알아보자.
0. 목차
- 유전자의 on/off
- 유전자의 on/off를 바꾸는 메커니즘
- 에피게놈 정보는 다음 세대에 전해지는가?
- 질병에도 '에피게놈'이 깊게 관여한다.
- 에피게놈 편집(Epigenome Editing)
- 에피게놈 약(Epigenome Medicine)

1. 유전자의 on/off
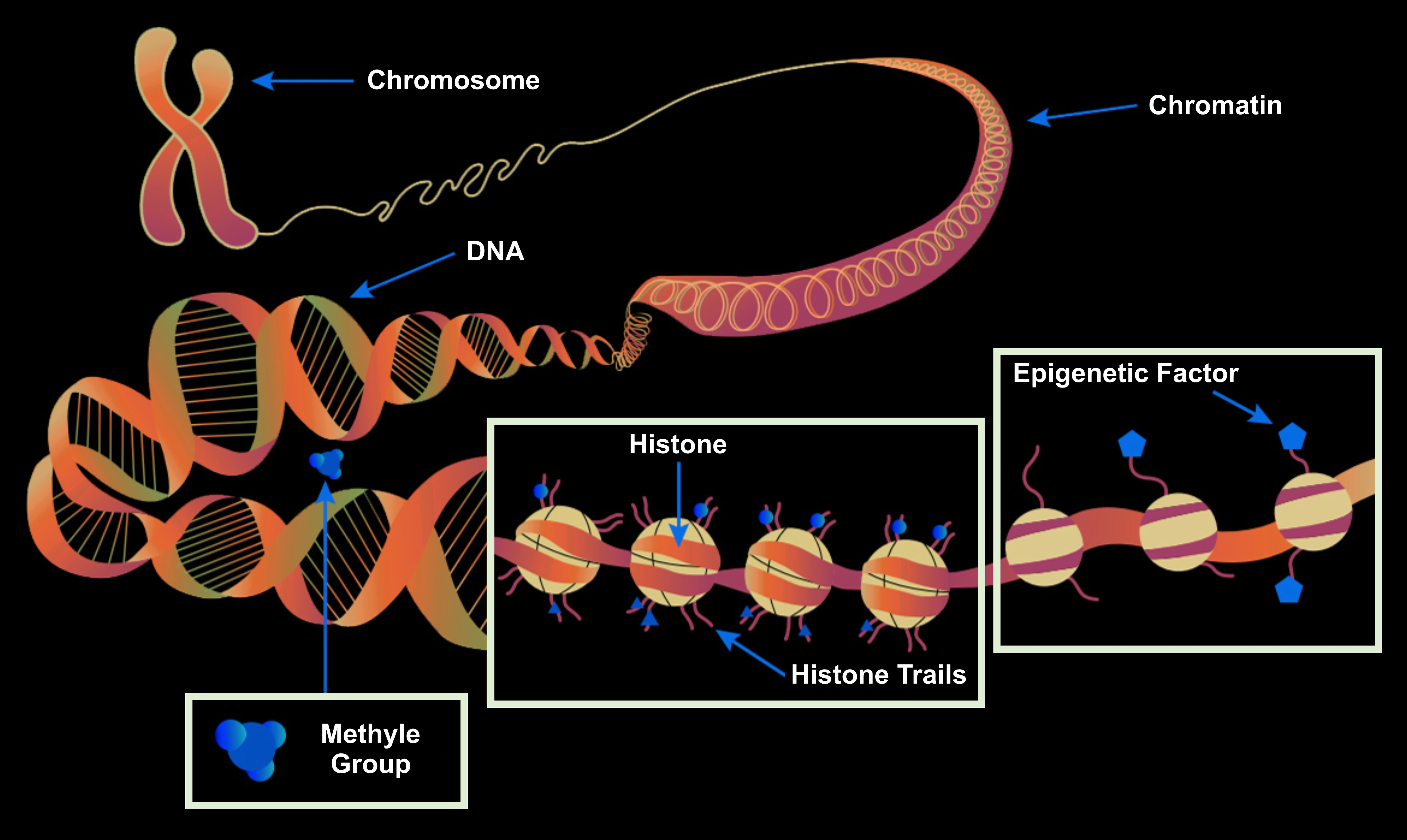
유전 정보를 담당하는 DNA는 '염기'가 늘어서 2개의 끈이 비틀린 사다리 같은 구조로 되어 있다. 염기는 '아데닌(Adenine)', '티민(Tymine)', '구아닌(Guanine)', '사이토신(Cytosine)'의 4종이 있으며, A는 T와 쌍을 이루고 G는 C와 쌍을 이루고 마주 보고 있다. 이 '염기 배열(염기쌍이 늘어선 방식)'이 유전 정보로 작용한다. 인간의 경우, 하나의 세포 핵 속에 들어 있는 DNA의 길이는 2m에 이른다. 이렇게 가늘고 긴 DNA는 '히스톤(Histone)'이라는 단백질에 감겨 몇 겹으로 강하게 묶여 있다. 한편 '유전자(Gene)'는 DNA 중에서 '단백질의 아미노산 배열 방식'이 기록되어 있는 극히 일부의 영역으로, 실제로 우리 몸을 만드는 정보가 기록되어 있는 영역이다. 즉, 유전자는 세포 안에서 다양한 작용을 하는 단백질의 설계도라고 할 수 있다.
'단백질 분자'는 '아미노산 분자'가 연결되어 이루어지며, 이 설계도에는 단백질의 아미노산 배열 방법에 대한 정보가 적혀 있다. 유전자가 작용할 때는 먼저 그 유전자 부분의 염기 배열이 해독되고 'RNA'에 복사된다. 이처럼 단일 가닥 DNA를 주형으로 RNA가 합성되는 과정을 '전사(Transcription)'라고 한다.
RNA에는 단백질을 합성기 위한 장치가 세팅되어 있기 때문에, 복사된 정보대로 아미노산이 이어진다. 이처럼 RNA의 염기배열을 아미노산의 배열로 변환하는 과정을 '번역(Translation)'이라고 한다. 이러한 아미노산이 올바른 모양으로 연결되어 겹쳐진 것이 단백질이며, 단백질은 세포 안에서 '정보의 전달', '물질의 운반', '물질의 분해' 등 다양한 기능을 발휘한다. 유전자가 'on' 상태라 함은 그 유전자가 설계도에 따라 단백질이 활발하게 만들어지고 있는 상태를 말하고, 유전자가 'off' 상태라 함은 단백질이 만들어지지 않고 있는 상태를 말한다.
2. 유전자의 on/off를 바꾸는 메커니즘
2-1. 스위치 역할을 하는 '프로모터'
그렇다면 유전자의 on/off는 어떻게 바뀔까? 사실은 각각의 유전자 근처에는 스위치 역할을 하는 별도의 염기 배열인 '프로모터(Promoter)'가 있고, 거기에 특수한 단백질인 '전사 인자(Transcription Factor)'가 결합하면 유전 정보가 RNA에 복사된다. 반대로 '전사 인자'가 떨어져 '프로모터'와 결합하지 않은 상태에서는 복사되지 않는다. 결국, 유전자가 on이 된다는 것은 프로모터에 전사 인자가 결합함을 의미하며, 유전자가 off된다는 것은 프로모터에 전사 인자가 결합하지 않음을 의미한다. 마치 복사기의 스위치를 누르면 원고가 종이에 복사되고, 스위치를 누르지 않으면 복사되지 않는 것과 비슷하다. 이때 '프로모터'의 염기 배열이나 '전사 인자'의 종류에 따라, 서로 쉽게 결합하거나 결합하기 어려운 경우가 생긴다. 이런 유전자의 on/off 조절은 DNA의 염기 배열에 맡겨진다.
하지만 유전자의 on/off에는 '염기 배열을 따르지 않는 옵션'도 준비되어 있다. 약간 복잡한 메커니즘이므로, 알기 쉽도록 4종의 염기를 음표로 비유해 보자. 유전자와 프로모터의 염기 배열은 악보가 된다. 악보를 바탕으로 오케스트라가 연주될 때는 지휘자가 음의 강약이나 템포를 조절해, 같은 곡이라도 지휘자에 따라 분위기가 미묘하게 바뀐다.
유전자의 on과 off에도 지휘자에 해당하는 메커니즘이 있다. DNA나 DNA가 감기 히스톤의 일부에 특수한 '표지(Marker)'를 결합시켜 on/off를 조절하는 것이다. 예컨대 DNA 염기 가운데 '사이토신(Cytosine)'에 '메틸기(Methyl Group)'라는 표지가 붙는 경우가 있다. 이것을 'DNA의 메틸화(DNA Methylation)'라고 하며, 메틸화된 프로모터에는 '전사 인자'가 결합할 수 없어 유전자의 스위치는 off가 된다. 역으로 '탈메틸화(붙어있던 메틸기가 떨어지는 일)'가 일어나면 '전사 인자'가 결합할 수 있게 되어 유전자의 스위치는 on이 된다.

2-2. 에피게놈(Epigenome)
한편, DNA에 감긴 '히스톤(Histone)'에 '표지(Marker)'가 붙은 경우도 있다. 히스톤의 일부가 '메틸화(Methylation)'되면 DNA가 더욱 강하게 묶여, 전사 인자가 DNA에 접근할 수 없게 된다. 결국 유전자의 스위치는 off가 된다. 역으로 히스톤에 '아세틸기'라는 표지가 붙은 '아세틸화'가 일어나면 히스톤의 DNA를 묶는 힘이 약해져, 전사 인자가 DNA에 접근할 수 있게 된다. 결국 유전자의 스위치는 on이 된다.
이러한 방식으로 DNA나 히스톤에 특정 표지를 붙여 유전자 스위치의 on/off를 조절하는 메커니즘을 '에피게놈(Epigenome, 후성유전체)'라고 한다. epi-는 '바깥쪽' 또는 '추가한다'는 뜻의 접두어이다. 표지를 붙이고 떼는 것은 세포 안의 '메틸화 효소(Methylase)'와 '탈메틸화 효소(Demethylase)', '아세틸화 효소(Acetylase)' 등의 단백질로, 통틀어 '에피게놈 효소(Epigenome Enzyme)'라고 한다.
앞에서 수정란에서 몸이 만들어지는 '발생 과정'이나 '성장 과정'에서 세포별로 유전자의 on/off가 엄밀하게 제어된다고 말했다. 이때에도 '에피게놈(Epigenome)'이 큰 역할을 담당한다.
3. 에피게놈 정보는 다음 세대에 전해지는가?
'에피게놈(Epigenome)'의 자세한 메커니즘에 대한 연구는 최근에 활발해졌지만, 현상 자체는 예전부터 알려져 있었다. 예컨대 1959년에 일본계 미국인 생물학자인 '스스무 오노(Susumu Ohno, 1928~2000)' 박사는 포유류 암컷의 세포에 있는 'X 염색체' 가운데 하나가 까맣게 응집되어 있는 것을 관찰했는데, 이것이 나중에 DNA의 메틸화나 히스톤의 탈아세틸화에 의한 X 염색체의 비활성 발견으로 이어졌다.
'염색체(Chromosome)'란 DNA가 빽빽하게 접힌 막대 모양의 구조체로, 세포가 분열할 때 나타난다. 포유류의 경우, 암수를 결정하는 '성염색체'는 X 염색체와 Y 염색체 2종이 있다. 암컷 세포에는 X 염색체가 2개, 수컷에는 X 염색체와 Y 염색체가 1개씩 있다. X염색체에는 발생, 분화, 생명 유지에 필요한 유전자가 1500개 정도 있다. 원래대로라면 암컷의 경우는 수컷의 2배의 유전자가 작용하게 된다. 그렇게 되지 않도록 암컷의 세포에서는 발생의 극히 초기에 X염색체 1개분의 유전자가 모두 off된다.
어떤 한 사람의 몸속에 붙여진 'DNA 정보'와 '에피게놈 정보(히스톤의 표지)'는 세포 분열을 거쳐도 대부분 그대로 전해진다. 단 새끼에게는 전해지지 않는다고 한다. 부모의 '에피게놈 정보'는 수정란 시점에서 한번 '리셋(Reset)'되고, 새끼에게는 새로운 '에피게놈 정보'가 붙여진다고 한다.
다만, 에피게놈가 다음 세대에서 리셋된다는 메커니즘에 예외가 있을지도 모른다고 생각하고 있다. 쥐를 통한 한 실험에서는, 저영양 모친에게서 태어난 쥐는 보통으로 태어난 쥐보다 성장한 다음 뚱뚱해지기 쉽다는 점이 확인되었다. 태아기~태어난 직후의 영양 상태로 조절되는 '지질을 대사하는 일련의 유전자'의 에피게놈에 이상이 생겼기 때문이라고 생각된다. 에피게놈의 일부가 세대를 넘어 전해졌기 때문이 아닐까 생각하는 것이다. 인간의 경우도 같은 현상이 일어나고 있다고 생각된다.
4. 질병에도 '에피게놈'이 깊게 관여한다.
에피게놈 정보는 살아가는 과정에서 그때그때의 환경의 영향을 받아 미묘하게 변한다. 예컨대 일란성 쌍둥이가 나이를 먹어가면서 몸매에 차이가 나는 이유는 '에피게놈(Epigenome)' 때문이라고 할 수 있다. 일란성 쌍둥이는 똑같은 게놈을 가지고 있지만, 오랜 기간 걸친 영양 상태와 스트레스 등의 환경 차이로 인해 에피게놈이 미세하게 변해서 유전자의 on/off를 미묘하게 바꾸기 때문이다.
질병에도 '에피게놈'이 깊숙이 관여하고 있다. 지휘가 엉망인 오케스트라에서는 연주자의 실력이 좋아도 템포가 얽히거나 불협화음이 생기듯이, 유전자에 이상이 없어도 에피게놈의 이상으로 다양한 질병에 걸릴 수 있다. 예컨대 신경이나 내분비계에 이상이 생기는 '프레더-윌리 증후군(Prader-Willi Syndrome)'이나 몸이 작은 채로 성장하지 못하는 '러셀-실버 증후군(Russel-Silver Syndrome)' 등이 있다. 또 태아기에 DNA의 디메틸화 효소가 제대로 작용하지 않으면 병원체 등과 싸우는 면역에 이상이 생기는 'ICF 증후군(ICF Syndrome)'이 생긴다. 더 일반적인 질병으로는 '조현병(정신분열병)', '양극성 기분 장애(조울증)' 등의 '정신 질환', 면역계가 자신의 세포를 공격하는 '면역 질환' 등의 일부에 '에피게놈' 이상이 관여하고 있다고 한다.
5. 에피게놈 편집(Epigenome Editing)
이제부터는 '에피게놈 편집(Epigenome Editing)'에 대해 알아보자.
5-1. '게놈 편집' 기술이 개발되었다.
생물의 '게놈(Genome)'을 바꾸는 방법은 1970년대부터 개발되기 시작했다. 1970년대부터 특정 유전자를 생물의 유전자에 도입하는 '유전자 변형'이 이루어져 많은 연구자가 유전자 변형 쥐를 사용하게 되었다. 단, 유전자 변형 기술로는 목적한 유전자를 목표로 한 게놈의 부위에 정확하게 삽입할 수 있는 것이 아니어서, 우연히 좋은 위치에 들어간 쥐를 골라내야 했다. 예컨대 예컨대 특정 '프로모터(Promoter)' 뒤 등 목표로 한 부위에 정확하게 삽입할 수 있는 것이 아니었다. 그래서 정확성과 효율성이 떨어지고, 방대한 시간과 비용이 든다는 단점이 있었다.
하지만 1996년 이후, DNA의 특정 연기 배열을 인식해 절단하는 효소를 합성할 수 있게 되었다. 그리고 이들 효소를 사용해 특정 유전자를 원하는 위치에 삽입하거나 특정 유전자를 빼낼 수 있게 되었다. 게놈 중의 유전자를 마음대로 바꿀 수 있다는 점에서 '게놈 편집(Genome Editing, 유전체 편집)'이라고 불리게 된 기술이다.
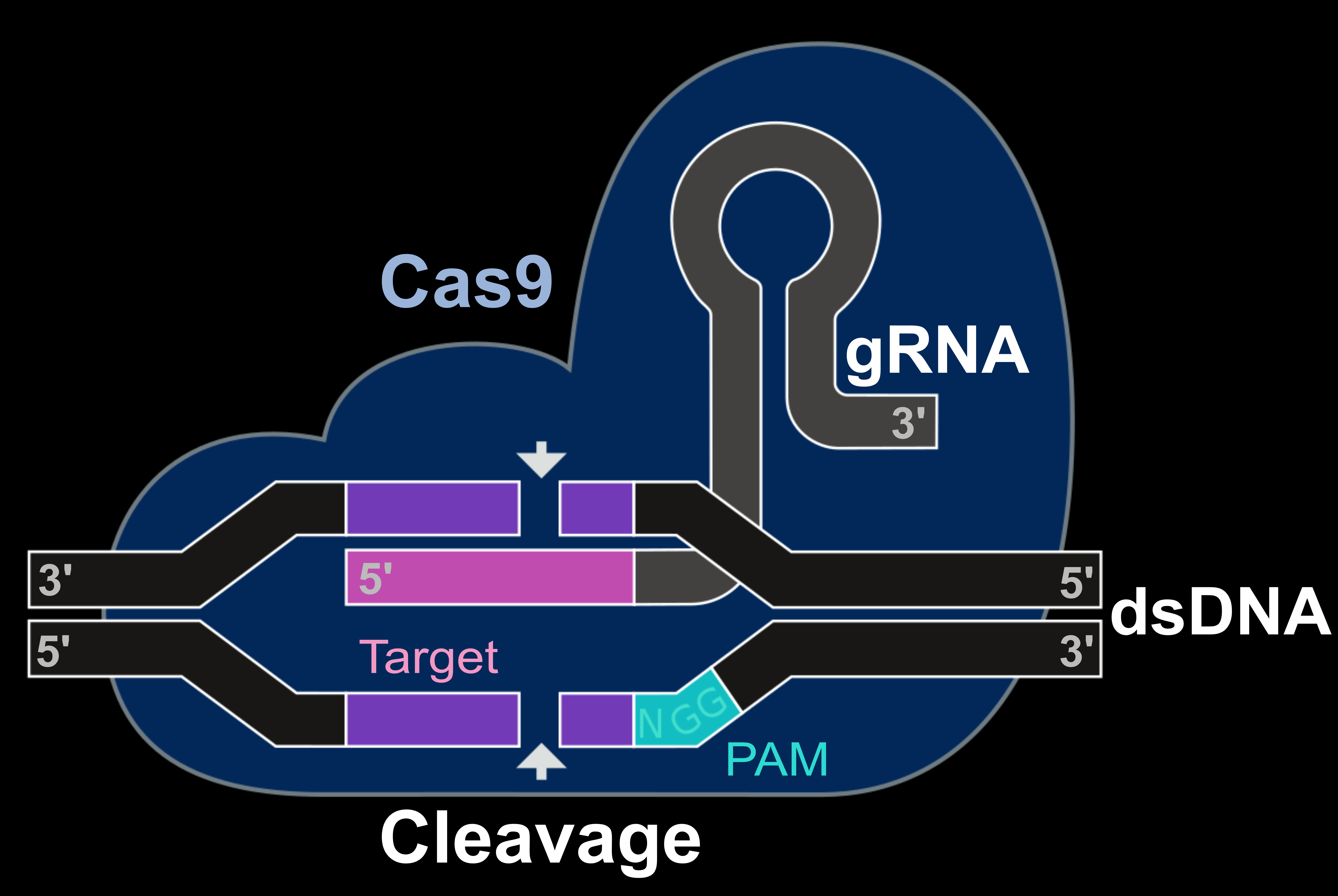
초기의 게놈 편집은 절단하려고 하는 염기 배열별로 효소를 만들어야 했기 때문에, 일부 연구자만이 사용하는 기술이었다. 하지만 2013년에 간단하고 효율적으로 게놈 편집을 할 수 있는 방법인 'CRISPR/Cas9(크리스퍼 캐스 나인)'이 등장하면서 상황이 크게 변했다. CRISPR/Cas9는 '가이드 RNA(Guide RNA)'와 'Cas9'으로 이루어진다. '가이드 RNA'는 DNA의 절단하고 싶은 염기 배열과 Cas9에 결합하도록 만든 인공적인 RNA이다. 'Cas9'은 DNA를 절단하는 기능과 '가이드 RNA'와 하나가 되어 표적 배열을 찾는 능력이 있다. 그리고 표적 배열에 도달하면, 바로 '가이드 RNA'가 결합한 DNA 부위를 절단한다. CRISPR/Cas9에서는, 절단할 DNA의 배열에 다라 가이드 RNA를 합성해야 하지만, 효소의 합성과는 달리 그다지 어렵지 않다. 한편, Cas9은 어떤 배열을 절단하는 데도 사용할 수 있다. CRISPR/Cas9는 사용하기 편한 편집 기술로, 순식간에 아주 당연한 연구 도구가 되었다.
5-2. '게놈 편집' 기술을 응용해 유전자의 on/off도 조작한다.
사실 이런 '유전체 편집(Genome Editing, 게놈 편집)' 기술이 결국 '원하는 부위의 DNA나 '히스톤(Histone)'에 '메틸기(Methyl Group)'를 붙이거나 떼어내는 조작을 가능하게 했다. 즉 '에피게놈의 수정'이 가능하게 된 것이다. 여기서 이용하는 것은 '가이드 RNA'와 'dCas9(DNA를 절단하는 능력을 잃은 Cas9)', 그리고 dCas9에 결합된 '에피게놈 효소(Epigenome Enzyme)'이다. 이러한 설계도가 되는 유전자를 세포 안에 집어넣으면 '가이드 RNA'가 결합한 DNA 부위의 바로 옆에 있는 '프로모터(Promoter)'나 '히스톤(Histone)'에 '에피게놈 효소'가 작용해 '메틸화(Methylation)나 '탈메틸화(Demethylation)를 일으킬 수 있다. 연구자에 따라 방식은 다소 다르겠지만, 기본적으로 'Cas9'과 '에피게놈 효소의 설계도가 되는 유전자', 그리고 '가이드 RNA의 바탕이 되는 유전자를 모두 연결한 것(카세트 등의 이름으로 불리는 DNA 조각)'을 만들어 세포에 집어넣는 것이 기본이다.
세포에 집어넣는 방법으로는 '직접 주입하는 방법', '바이러스 벡터로 집어넣어 세포를 감염시키는 방법', '플라스미드에 연결해 세포를 집어넣는 방법' 등을 도입할 수 있다. '바이러스 벡터(Viral Vector)'란 유전자의 운반자로 이용하기 위해 독성을 없앤 바이러스이다. '플라스미드(Plasmid)'는 세균이나 효모가 핵 밖에 가지고 있는 고리 모양의 DNA이다.
6. 에피게놈 약(Epigenome Medicine)
'암세포만이 가진 특수한 단백질'에 작용해 암세포를 억제하며 정상 세포에는 작용하지 않는 치료약, 즉 '분자 표적약'이 10종 이상 실용화되어 있다. 그런데 이러한 분자 표적약 가운데 '에피게놈(Epigenome)'을 바꾸는 유형도 있는데, 이런 약을 '에피게놈 약(Epigenome Medicine)'이라고 한다.
예를 들어 혈액 암의 일종인 '골수 형성 이상 증후군(Myelodysplastic Syndrome)'에 사용되는 '아자시티딘(Azacitidine)'에는 암세포에서 일어나는 비정상적인 메틸화를 방해하는 기능이 있다. 암세포에서는 세포의 암화를 억제하는 '암 억제 유전자'의 스위치가 메틸화에 의해 꺼져 있는 경우가 많다. '아자시티딘'은 메틸화를 방해함으로써, 억제되어 있던 '암 억제 유전자'를 다시 활성화해서 치료 효과를 발휘한다고 생각된다. 또 '피부 T세포성 림프종(Cutaneous T-cell lymphomas)'이라는 암에 사용되는 '보리노스타트(Vorinostat)'라는 약은 히스톤의 비정상적 탈아세틸화를 약화시켜 암세포가 정상 세포의 성질과 비슷하게 작용하게 한다.
단, '아자시티딘(Azacitidine)'과 '보리노스타트(Vorinostat)' 모두 게놈의 목표 부위에만 작용하는 것이 아니라 게놈 전체에 대략 작용한다. 그래서 암을 억제하는 효과가 강력하지 않아 항암제 등과 병용해서 사용된다. 만약 더 나은 '에피게놈 편집 약(Epigenome Editing Medicine)'이 만들어지면 '암 억제 유전자'의 스위치만을 확실하게 on 상태로 할 수 있게 되어, 치료 효과가 훨씬 높아질 것이다.
다만 '에피게놈 편집(Epigenome Editing)'을 질병 치료에 이용하기 위해서는 '카세트 운반'이나 '정밀도 향상'에 관련한 기술 개량을 해야 하며 아직 시간이 필요하다. 그 밖에도 해야 할 일이 많다. 2010년에는 '국제 인간 에피게놈 심포지엄(IHEC: International Human Epigenome Consortium)'이 설립되어, 각국이 분담해 질병과 생명 현상에 관여하는 '에피게놈의 정보를 수집하기 시작했다. 하지만 수집된 에피게놈 정보가 민족 간에 다를 가능성도 생각해야 한다.
| 암 억제 유전자 | 각 암에서 메틸화 이상이 발견된 비율 |
| BNIP3 | 대장암(66%), 유방암(49%) |
| BRCA1 | 유방암(29%) |
| CHFR | 대장암(40%), 폐암(19%) |
| ER | 전립선암(100%), 유방암(49%) |
| p14 | 급성 골수성 백혈병(65~85%) |
| RARB | 유방암(81%), 폐암(41~81%) |
| RASSF1A | 신장암(23~91%), 전립선암(63~71%), 췌장암(64%), 유방암(32~62%), 신경아세포종(55%), 식도암(52%), 위암(43%), 폐암(40%), 방광암(31%), 대장암(20%) |
| SFRP1 | 대장암(95%), 난소암(12%) |
| TSLC1 | 폐암(83%), 식도암(50%), 위암(16%), 췌장암(27%) |